абстрактно
Кетогенните диети с високо съдържание на мазнини увеличават кетоните (ацетоацетат, β-хидроксибутират и ацетон) и се използват за лечение на рефрактерни гърчове. Въпреки че кетозата е неразделен аспект на тези терапевтични режими, прякото значение на кетозата за контрол на гърчовете изисква допълнителни изследвания. Изследването на тази връзка изисква надеждно, минимално инвазивно измерване на кетозата, което може да се извършва често. В това проучване ние изследвахме използването на дихателен ацетон като мярка за кетоза при деца с рефрактерни гърчове на класическа кетогенна диета. Резултатите бяха сравнени с нивата на ацетон в дъха при епилепсия и здрави контроли. Децата на кетогенна диета са имали значително по-висок ацетон на гладно в сравнение с епилепсия или здрави контроли (2530 ± 600 nmol/L спрямо 19 ± 9 nmol/L и 21 ± 4 nmol/L, p 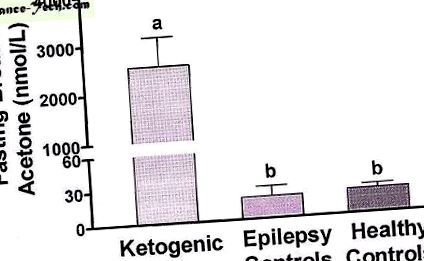
Ацетон на гладно, деца на кетогенна диета, контроли за епилепсия и здравословни контроли. Баровете с различни букви са значително различни (стр
(Отгоре) ACET дишане при деца с KD, контрол на епилепсията и здравословен контрол. F, бързо; И 1 час, 1 час след консумация на кетогенна храна. * Значително по-голямо от гладуването в същата група. (Отдолу) Променете дъха на ацетон 1 час след консумация на кетогенна храна при деца с KD, контроли за епилепсия и здравословни контроли.
Изображение в пълен размер
Няма значима връзка между възрастта и ACET на гладно и в двете групи. Имаше значителна отрицателна връзка между възрастта и промяната в дишането на ACET при здрави контролни пациенти, но не и при деца с KD и епилепсия (R2 = 0,28, p = 0,044; Фиг. 3). Имаше значителна експоненциална връзка между% IBW и ACET на гладно при здрави контролни пациенти, но не и при деца с KD и епилепсия (R2 = 0,32, p = 0,042; Фиг. 4).
Връзка между възрастта и промяната на дишането ACET при здрави контроли. Връзката е най-добре описана чрез линеен модел, Y = A + BX, A = 20, 169, B = -1, 703; R2 = 0,28, p = 0,044.
Изображение в пълен размер
Връзка между процента на идеалното телесно тегло и ACET при здрави контроли на гладно. Връзката беше най-добре описана чрез уравнението на експоненциалното разпадане, Y = A * (e - BX), A = 60, 9834, B = 0.0006; R2 = 0,32, p = 0,042.
Изображение в пълен размер
В групата с KD не се наблюдава значим ефект от добавянето на карнитин на гладно и промяна в дишането на ACET. Наблюдава се отрицателна експоненциална връзка между времето към KD и ACET на гладно (R2 = 0,55, p = 0,014; Фиг. 5). Въпреки това, няма значителна връзка между продължителността на времето на KD и промяната в дишането ACET.
Връзка между времето за KD и дишането на гладно ACET. Връзката беше най-добре описана чрез уравнението на експоненциалното разпадане, Y = A * (e - BX), A = 3041, 48, B = 0,0332; R2 = 0,55, p = 0,014.
Изображение в пълен размер
По време на 9-часовия период ACET дъхът остава относително стабилен при едно дете с епилепсия на KD, независимо дали се оценява чрез газова хроматография или HHBAA (фиг. 6). Разликата между газовата хроматография и HHBAA ACET стойностите е 1,1% (фиг. 6).
Респираторен ACET като функция на времето при дете на KD. Фиксирана колона, измерена HHBAA; пунктирана линия, измерена с газова хроматография.
Изображение в пълен размер
ДИСКУСИЯ
През 1927 г. Talbot et al. (26) изследва биохимичните ефекти на гладуването при деца с епилепсия и коментира „значителна екскреция на ACET тела, показани качествено в дъха и урината“. Пет години по-късно, в дискусия за механизма на KD, Bridge и Iob (27) отбелязват общата обратна връзка между честотата на пристъпите и концентрацията на кетони в кръвта, урината и издишания въздух. Въпреки че ACET за дишане се използва качествено като индикатор за кетоза при деца с неконтролируеми гърчове на KD, не знаем предишни доклади за количествени измервания на ACET в дишането при тази популация.
Измерване на дихателния ACET при деца с KD и епилепсия също не се съобщава. Въпреки това, ACET в дъха на здрави деца варира от 3 до 66 nmol/l (28), което е много подобно на диапазона, открит при здрави деца в това проучване (6–61 nmol/l). При деца на възраст 0, 1 - 16 години Nelson et al. (28) установяват значителна отрицателна връзка между възрастта и дишането на ACET. Настоящото проучване не открива значителна връзка между възрастта и дихателния ACET; установена е обаче значителна отрицателна връзка между възрастта и промяната в дишането на ACET 1 час след консумация на кетогенна закуска. Колкото по-младо е детето, толкова по-голямо е след дишането увеличение на ACET дъха. При здрави деца също имаше значителна експоненциална връзка на разпадане между% IBW и ACET на гладно, което предполага, че децата, по-тежки от IBW, имат по-нисък ACET на гладно. Това откритие е в съответствие с предишни наблюдения, че по-тежките индивиди са по-устойчиви на развитието на кетоза (29).
В това проучване ACET на гладно е сходен при здрави и епилептични контроли и се увеличава значително от гладуването 1 час след консумация на кетогенна храна. Изглежда, че епилепсията и антиконвулсантите не влияят на производството на ACET или ACET на гладно. Тъй като ACET и антиконвулсантите фенобарбитал (Luminal) и фелбамат (Felbatol) се метаболизират от цитохром P450 2E1 (30), предположихме, че децата с епилепсия на тези антиконвулсанти ще имат по-ниски нива на ACET в дишането в сравнение със здравите контроли. Тъй като нито едно от децата в това проучване не е използвало някое от тези антиепилептични лекарства, ефектът на тези лекарства върху ACET изисква допълнително проучване.
В сравнение със здравия и епилептичния контрол, децата с KD епилепсия са имали 125 пъти по-висок ACET на гладно. Един час след консумация на кетогенна закуска, дишането на ACET не се е увеличило значително от гладуването, което предполага, че децата на KD в продължение на поне 1 месец са в стабилна или максимална кетоза. Въпреки че карнитинът е от съществено значение за усвояването на митохондриите (и по този начин за окисляването) на дълговерижни мастни киселини, децата с KD, допълнени с карнитин, не са имали значително по-висок ACET на гладно или значително по-голямо увеличение на ACET дишането след хранене.
Имаше значителна обратна връзка между продължителността на времето на KD и ACET на гладно. Това намаляване на ACET с течение на времето може да се дължи на 1) по-лошото спазване на диетата с течение на времето; 2) увеличаване на поглъщането на ACET тъкан; 3) увеличаване на разграждането на ACET от цитохром P450 2E1; или 4) повишен метаболизъм на ACET, тъй като ACET може да се използва в глюконеогенезата, липогенезата и синтеза на протеини (31). Нашите текущи резултати не могат ясно да разграничат тези опции. Предишни проучвания при животни показват тенденция плазменият AcAc, плазменият β-HBA и ACET дъхът да намаляват с течение на времето, без промяна в формулирането/приема на KD (9, 22). По този начин в тези проучвания с животни по-лошият прием на храна с течение на времето не е взел предвид това намаляване на кетозата.
Изглежда имаше малка колебание в дишането на ACET през деня. Пробите от дишането се анализират на всеки час чрез газова хроматография и HHBAA. Стойностите на газовата хроматография и HHBAA бяха в много тясно съгласие, което предполага, че HHBAA може да бъде точно измерване на дихателния ACET. Коефициентът на вариация при трикратни проби от дишане също е много нисък, което предполага, че HHBAA трябва да бъде надеждна мярка за дишане ACET. Тези предварителни резултати са обещаващи и предполагат, че HHBAA може да се използва за измерване на дихателния ACET извън лабораторните условия. В момента се провеждат проучвания за оценка на степента на чувствителност на ACET HHBAA, както и неговата чувствителност към други дихателни компоненти. Нашата цел е да използваме HHBAA за оценка на връзката между кетоза и защита от гърчове при деца с неконтролируеми гърчове на KD.
Очакваме, че много деца на KD ще бъдат или твърде малки, или твърде забавени в развитието/когнитивното развитие, за да използват HHBAA. В сътрудничество с Alcohol Countermeasure Systems Inc. (Mississauga, Онтарио, Канада) Накрая се надяваме да проектираме HHBAA със сензор, който е достатъчно чувствителен и специфичен за ACET, за да може да се генерира отчитане от проба за пасивно дишане. Тъй като този тип дихателна проба не е представителна за алвеоларния въздух, ще трябва да се приложи корекционен фактор. Алтернативно, маска за лице, свързана с вентилационна система без вентилационен клапан, като системата, описана от Nelson et al. (28), може да се използва за вземане на проби от дъха.
