елементи
абстрактно
9-11 nm) с диаметър на порите
Резултати и дискусии
Взаимодействието на Ang II с лизениновите канали увеличава преходните промени в йонния ток
Основната експериментална настройка за анализ на взаимодействията между Ang II и отделните лизенинови канали, която е обичайна за изследванията на транслокация на макромолекули, е описана подробно в раздела Методи. Поставянето на единичен лизенинов канал в мембраната е показано с постоянен отворен ток
-122 pA при -60 mV потенциал за отклонение (фиг. La), след което разтворът в цис резервоара е заменен за безлизенов електролит, за да се предотврати по-нататъшното вмъкване. След смяната на буфера обаче могат да се вмъкнат повече канали, тъй като образуването на предварителни пори, прикрепени към мембраната, е условие за олигомеризацията на каналите 36. Въпреки че не открихме никакви промени в характерните електронни подписи, получени от едноканални измервания за до шест вградени нанопорта (след което електрическият шум може да стане значителен и да попречи на точен анализ), всички експерименти за транслокация на отделни канали постоянно съдържат две лизенинови нанопори, сглобени в липидна мембрана.
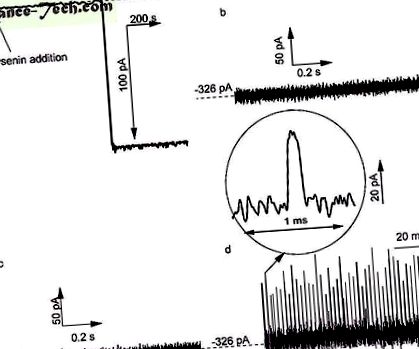
Взаимодействие на Ang II с единични лизенинови канали, вградени в липидни мембрани, окъпани с 1 M KCl разтвори, буферирани с 10 mM Tris и 1 mM EDTA при рН 6.9. а ) Въвеждането на един канал в двуслойната мембрана се наблюдава като стъпкова промяна в йонния ток при трансмембранен потенциал от -60 mV (време за вземане на проби 1 s, 1 kHz нискочестотен хардуерен филтър и 10 Hz нискочестотен софтуерен филтър) . Не се наблюдават преходни промени в йонния ток, определени през двата отворени лизинови канала при -80 mV, когато: ( б ) не се добавя Ang II към разтвора и ( ° С ) Ang II беше добавен към транс резервоара. ( д ) Добавянето на Ang II към цис резервоара осигури множество преходни промени в йонния ток, показващи взаимодействия между канала и пептидите. Следи, показани на панелите ( б - д ) са записани с време за вземане на проби от 4 μs и 10 kHz нискочестотен хардуерен филтър.
Изображение в пълен размер
При липса на пептиден аналит на Ang II, добавен към външни разтвори, следата от йонния ток, записана през двата канала при -80 mV и висока времева разделителна способност (време за вземане на проби от 4 μs), показва липсата на някаква преходна промяна в отворената текуща следа (Фиг. . 1b) и ниско ниво на шум (1 Ang II в резервоара на транс-резервоара) за иначе идентични експериментални условия и времеви диапазон (фиг. 1в), което показва, че определена посока на електрическото поле предотвратява всякакви взаимодействия нанопор-аналит. добавянето на пептид към цис-резервоара при -80 mV трансмембранен потенциал дава чести и кратки преходни промени в йонния ток (фиг. 1г), показващи пептидни взаимодействия с отворен канал 13, 14, 15, 16, 42, 43 44, 45, 46 .
Двата основни типа записани събития могат да бъдат класифицирани като измествания или сблъсъци
Внезапни и преходни промени в йонния ток, индуцирани от добавянето на Ang II към цис страната, са подобни на електронния подпис на пептиди, взаимодействащи с други биологични нанопори 11, 14, 16, 43, 44, 45, 46. Извършен е задълбочен анализ на електронния преходен подпис със софтуерния пакет Transalyzer 47 за всяко отделно събитие по отношение на средната промяна на тока по време на преходната блокировка и времето на престой, tD. Графиката на плътността на събитията, записана при -80 mV (фиг. 2а), показва два клъстера, често срещано явление, което се случва при макромолекули, преместени през синтетични и естествени нанопори 11, 14, 43, 48. Наличието на двата клъстера предполага различни сигнални взаимодействия на пептидните канали, които могат да представляват противоположната ориентация на молекулите, влизащи в нанопора 7, сгъване, олигомеризация 11, свързване 46 или неуспешни опити за транслокация, когато молекулите се сблъскат само с отвора на канала 14, 43. Клъстерите, показани на фиг. 2а са различни и следователно могат лесно да бъдат разделени на два класа събития, наречени E1 и E2. По-нататъшен анализ на събитията, принадлежащи към всеки клас, показа относително тясно и симетрично разпределение (фиг. 2б), с пикове при -26 рА (събития Е1) и -10 рА (събития Е2).
Анализ на блокиращи събития, записани след добавянето на Ang II към цис резервоара при -80 mV трансмембранен потенциал. ( а ) Графиката на плътността показва два добре дефинирани клъстера (наречени E1 и E2), което позволява отделен анализ на всеки отделен клъстер. Цветът показва плътността според вмъкнатата скала. ( б ) хистограмите (ширина на резервоара 3 pA) представляват пикове при -26 pA (събития E1) и -10 pA (събития E2). ( ° С ) Разпределението на събитията за всеки от двата клъстера по отношение на tD е представено от хистограми (ширина на стека 0,02 ms) с пикове при
70 µs (събития E1) a
120 µs (събития E2). За по-добро наблюдение на припокриващи се разпределения е въведена празнина между контейнерите за събития E2. Анализираните събития са събрани от един експеримент за транслокация.
Изображение в пълен размер
описващи или събития Е1 или Е2 представляват по-малко от 25% от абсолютната стойност на отворения ток, което е много по-малко количество от измереното от експерименти, изследващи транслокацията на пептиди или къси полинуклеотиди през други биологични нанопори 8, 14, 16, 4349. Това несъответствие може да се отдаде на структурните свойства както на канала, така и на пептида. Неотдавна публикуваната структура на лизенин 35, 36 показва дължината на канала
Разпределенията на tD за двата клъстера (фиг. 2в), записани при -80 mV, са наклонени и асиметрични, с пикове при
70 µs (събития E1) a
120 µs (събития E2). За разлика от текущите блокови разпределения, които са добре разделени, наблюдаваме голямо припокриване между характеристиките t Ds на двата типа събития. В допълнение, събитията E1 показват тясно разпределение на tD, докато събитията E2 надхвърлят диапазона от 0,02 ms до повече от 0,4 ms (фиг. 2в). Предишни измервания на ts или за пептиди, или за къси олигонуклеотиди, преместени през α-HL или аеролизинови канали, показват разпределения, които следват експоненциалните разпадания, описани чрез характерни времена на релаксация като мярка за средно Tn 11, 13, 14, 16, 43, 46, 49. Нашите резултати може да не отговарят на такова описание, тъй като нито един от двата класа събития не може да бъде точно описан като комбинация от експоненциални затихвания.
Стресова зависимост на взаимодействията между отделните лизенинови канали и Ang II. ( а ) Средната стойност на събитията E1 (отворени квадрати) следва линейно приложеното напрежение, както се очаква за транслокации. За разлика от това, приложеното напрежение имаше много по-малък ефект върху текущото блокиране, характеризиращо събитията E2 (плътни квадрати). ( б ) Средното t D на преходните блокажи намалява с приложеното напрежение за събития E1 (отворени квадрати) и E2 (плътни квадрати). Данните в двата панела са изразени като средно ± sd, n = 3; всеки размер на извадката се състои от най-малко 2800 събития.
Изображение в пълен размер
Както сме интерпретирали по-рано, ние сме определили събития, характеризиращи се с по-малко токово блокиране и по-дълги времена на взаимодействие, съдържащи молекули, които попадат в порите и дифузират 14, 43 За разлика от това, по-големите токови блокади и по-кратките времена се считат за характерни за предполагаемите транслокации 14, 43. В резултат на това заключаваме, че събитията E1 са характерни за преместените молекули, а събитията E2 представляват сблъсъци с порите. Не можем обаче да изключим напълно възможността за групиране на ФИГ. 2а като произхождащи от различни ориентации на молекули, влизащи в порите 52, пептидно сгъване или други сложни междумолекулни взаимодействия между лизениновите канали и пептидите 46. Електронният подпис на пептидите, които преминават през нанопорите, силно зависи от естеството на аналита и нанопората, което затруднява сравнението между експериментите за транслокация, за които нито един от тях не е еднакъв.
По-нататък изследвахме ефекта от приложеното напрежение върху честотата на събитията за две различни популации. Както е показано на ФИГ. 4, честотата на събитията E1 или E2 се увеличава квазилинейно с увеличаване на амплитудата на трансмембранното напрежение, което преди беше наблюдавано при транслокацията на къси нуклеотиди или пептиди 8, 13. Широкото разпределение на експерименталните стойности на честотата, както се вижда от големите диапазони на грешки, може да се обясни с неравномерното смесване на разтворите след добавянето на Ang II. Също така забелязахме, че честотата на събитията се увеличава с времето, което може да се обясни с натрупването на пептиди с електрическо задвижване близо до отвора на канала. Струва си да се отбележи, че числата са разпределени относително равномерно между двете популации, независимо от използваното напрежение.
Влияние на напрежението върху честотата на събитието. Честота на събитието E1 ( а ) и E2 ( б ), изчислена за отделен лизинов канал, следва приложеното напрежение по квазилинеен начин. Експерименталните точки представляват средна стойност ± sd, n = 3.
Изображение в пълен размер
Доказателства за транслокация: LC-MS анализ
22 700). както е описано в раздела за методите).
След добавяне на Ang II към цис резервоара (крайна концентрация 10 μg ml -1) при -100 mV за приблизително 36 часа, разтворът се отстранява от резервоара за допълнителен анализ. LC-MS показва присъствието на Ang II в стандартната проба и в разтвора, взет от резервоара за транс (Фиг. 5a-d), показващ преминаването на Ang II през мембрана, съдържаща голяма популация лизенинови канали. Количеството на преместения Ang II (
0.8 ng), изчислена от калибрационната крива на MS-LC на стандартните количества, беше използвана за изчисляване на честотата на транслокация
Доказателства за транслокация на Ang II в големи популации от лизенинови канали, вградени в равнинна липидна мембрана. ( а ) MS на Ang II референтен разтвор (100 ng) идентифицира пептида при m/z = 349,5 (z = 3+). б ) LC хроматограма на еталонния разтвор Ang II. Пептидните молекули, преместени в транс резервоара при -100 mV за 36 часа, бяха открити и идентифицирани от MS ( ° С ) и LC ( д ). Прилагане на напрежение +100 mV ( д ) или блокиране на хитозанов канал ( е ) не позволи LC откриване на Ang II в транс резервоара.
Изображение в пълен размер
Може да се твърди, че при горните експериментални условия, противоположното електрическо поле може също да предотврати транслокация през непропускливата мембрана или че лизиновите канали могат да представляват напрежение, отчитащо приемането на свръхпроводими състояния 41, характеризиращи се с намален диаметър на пътя на проводника, несъвместим с транслокацията на големи молекули. Следователно, направихме подобен експеримент, при който мембраната беше отклонена с -100 mV (за насърчаване на транслокацията), но лизениновите канали бяха изложени на хитозан, необратим блокер на проводимостта на лизениновия канал 58. LC анализ на проби, извлечени от резервоара, не показва наличието на Ang II (фиг. 5е). Въпреки че е възможно спонтанна транслокация на Ang II да е настъпила на нива под границата на откриване на LC-MS, ясно е, че отворените лизенинови канали, поставени в мембраната, са отговорни за посредничеството при електрофоретично контролирана транслокация на Ang II, наблюдавано в това проучване. Заедно с електронния подпис, записан на отделните лизенинови канали в присъствието на пептида, нашата работа показва, че лизениновите канали позволяват на пептида да преминава през мембраната през проводящия път на нанопората.
заключения
Успешно демонстрирахме, че лизиновите канали, вградени в липидните мембрани, улесняват транслокацията на пептидни молекули, електрофоретично задвижвани от електрически полета. Това проучване добавя лизенин към кратък списък с обещаващи порообразуващи протеини, подходящи за разработването на вдъхновени от природата сензорни и характеризиращи устройства. Големият и еднороден диаметър на канала може да съдържа молекули, които са твърде големи, за да бъдат изместени от други биологични наночастици, като по този начин се разширяват възможностите за сканиране на нанометри за други биомолекулни анализи. По-нататъшно инженерство на канали чрез химически модификации и насочена към мястото мутагенеза за внедряване на подобрени или дори нови сензорни способности вече е възможно поради последните структурни данни на сглобените пори 35, 36. В допълнение, лизениновите канали представляват необичайни регулаторни механизми от физични и химични стимули, като напрежение или лиганди 41, 54. Външната модулация на проводящото състояние може допълнително да се използва за контролиран транспорт на биоактивни молекули през естествени и изкуствени липидни мембрани, временна клетъчна проницаемост, системи за доставка на лекарства, интелигентни превключватели и биоелектроника.
методи
Подготовка на двуслойни липиди Подготовка на мембраната и въвеждане на канали
Опростена скица на експерименталната настройка за транслокация Ang II. Отделни лизинови канали, вградени в равнинни двуслойни липидни мембрани, засегнати от трансмембранни стресове, могат да улеснят електрофоретично контролирано преместване на макромолекули през голям проводим път. Размерите на канала са от реф. 35.
Изображение в пълен размер
Транслокация на пептида през отделни лизенинови канали
Ang II се добавя към цис резервоара при крайна концентрация от 1 μg ml-1, последвано от разбъркване за около 10 секунди. Преходните събития бяха записани с протокол с променлива дължина при време за вземане на проби от 4 µs, 1 ms преди и след стартиране, хардуерен филтър от 10 kHz и се съхраняват за анализ с помощта на Clampfit 10.2 (Molecular Devices), Transalyzer 47, Matlab (Mathworks) и Origin 8.5 (OriginLab Corporation) софтуерни пакети. Времето на престой се изчислява като максимален полумаксимум за всяко отделно събитие, избрано за анализ, а текущите амплитуди се изчисляват като средно ниво между първия и последния локален минимум на всяко събитие 47. Тази процедура осигури най-доброто разделяне между събития E1 и E2.
Вмъкване на големи популации от лизинови канали
Експерименталният протокол за вмъкване на множество канали в двуслой е подобен на отделните канали, но включва по-голям диаметър за отвора в PTFE филма (
180 μm средно за побиране на по-големи популации от канали). По-голямо количество лизенин се добавя към цис резервоара (до 20 μl от 1 μM) и се използва по-малък обем електролит в транс резервоара (100 μl). Общият брой на вмъкнатите канали постепенно се увеличава чрез постепенно добавяне на лизенин, докато се достигне постоянен йонен ток.
-180 nA при -4 mV трансмембранно напрежение и след това буферираният електролит се променя, за да се отстрани лизенинът от насипния разтвор. Брой канали в мембраната (
22 700) се изчислява от съотношението между общата мембранна проводимост, определена от IV кривата, записана за тесния диапазон на напрежение (фиг. 7) и индивидуалната проводимост на канала (фиг. 7).
IV графика за големи популации от лизенинови канали, вградени в двуслойна липидна мембрана. Проводимостта, изчислена от наклона на кривата, беше използвана за оценка на броя на вмъкнатите канали.
Изображение в пълен размер
Блокада на лизениновите канали от хитозан. Добавянето на хитозан индуцира трайно и необратимо намаляване на макроскопичната проводимост при -4 mV трансмембранен потенциал, което показва блокада на канала.
Изображение в пълен размер
LC-MS анализ
Благодаря
Изследването, представено в тази публикация, е подкрепено от Националната научна фондация (номера на безвъзмездните средства 1554166, 0923535), Националните здравни институти (номера на безвъзмездните средства P20GM109095, P20GM103408) и Националната администрация по аеронавтика и космос (номер на безвъзмездните средства NNX15AU64H). Съдържанието е единствена отговорност на авторите и не представлява непременно официалните възгледи на агенциите за помощ.
Коментари
Изпращайки коментар, вие се съгласявате да спазвате нашите Общи условия и насоки на общността. Ако смятате, че това е обидно действие, което не отговаря на нашите условия или насоки, моля, сигнализирайте за неподходящо.