елементи
абстрактно
Пет до 10% от децата с de novo AML и до 23% от пациентите с рецидивирала AML имат рефрактерна болест, определена като неуспех за постигане на морфологична ремисия след два цикъла на химиотерапия. 1, 2, 3, 4 Тъй като честотата на AML при педиатричната популация в Обединеното кралство е 70 случая годишно, се очаква 8 до 12 деца годишно да бъдат огнеупорни AML в страната. В исторически план прогнозата за тази подгрупа пациенти е неутрална, като последните съвместни проучвания предполагат обща преживяемост (OS) от 22 и 14% за първична рефрактерна и рефрактерна детска ОМЛ. 3, 4
Все още не е установено най-доброто лечение за тези пациенти. Алогенната трансплантация на хематопоетични стволови клетки (SCT) е стандартът на грижа за високорискова фронтална или рецидивираща ОМЛ. 5, 6, 7 Данните за резултатите от пациентите, подложени на SCT за рефрактерна болест, са изкривени. Различните подходи и непоследователните кохорти дадоха много различни резултати, с преживяемост от 0-35% и свързана с трансплантация смъртност (TRM) до 40%. 4, 9, 8, 9, 10, 11, 12, 13, 14
По-конкретно, за деца, които не са в ремисия при трансплантация, са докладвани общо 160 пациенти в четири различни документа. 4, 8, 10, 14 Три от тези документи (включително две проспективни национални проучвания) документират 0% дългосрочна ОС за деца с активно заболяване в SCT. 4, 10, 14 За разлика от тях, Bunin et al. 8 документирани преживяемости без левкемия (LFS) 12% за деца с първична рефрактерна AML и 20% за рецидивирали рефрактерни пациенти. В допълнение, 19% от OS са докладвани в регистър анализ, комбиниращ данни за CIBMTR за възрастни и деца при 1428 пациенти с ОМЛ в ремисия при трансплантация. В този контекст като възможни комбинирани рискови фактори за по-лош изход са предложени процентът на взривове при трансплантация, несъответстващ или несвързан донор, лошо работно състояние и нискорискова цитогенетика.
Поради неблагоприятната прогноза на рефрактерната ОМЛ, неотдавнашен преглед обезсърчава доставката на SCT на възрастни с процент бласти> 25% в костния мозък (BM) при трансплантация. Няма препоръки за лечение на деца с подобна ситуация. За повечето от тези пациенти не са необходими други алтернативни възможности за лечение, така че са необходими допълнителни данни, за да се вземе информирано и съобразено с пациента решение. Това многоцентрово, ретроспективно проучване има за цел да оцени резултатите и да идентифицира прогнозни фактори за деца, получили първия SCT за първична рефрактерна или рецидивираща рефрактерна AML с активно заболяване в SCT.
Материали и методи
пациенти
Пациенти на възраст 0-18 години, които са претърпели първия алогенен SCT за първична рефрактерна или рецидивираща рефрактерна AML в 1 от 13 педиатрични трансплантационни центъра в Обединеното кралство между 2000 и 2012 г. и са докладвани на Британското общество за трансплантация на кръв и костен мозък ( BSBMT). за това проучване, ако са имали активно заболяване, документирано в рамките на 2 седмици от началото на режима на кондициониране. Пациенти с AML FAB M3 и юношеска миеломоноцитна левкемия бяха изключени от проучването. Рефрактерната болест се определя като> 5% бласти в BM или морфологично, или чрез цитогенетика или молекулярни методи или доказана екстрамедуларна (EM) болест след
2 цикъла на индукционна/реиндукционна химиотерапия.
Първичната индукционна недостатъчност се определя като> 5% взривове в BM или морфологично, или чрез цитогенетика или чрез молекулярни методи в края на втория индукционен курс.
CR се определя от BM с нормална хемопоеза и морфологично 6, 16
Изходните данни бяха потвърдени, за да се потвърди диагнозата рефрактерна болест при всички пациенти чрез изследване на морфологията и цитогенетичните/молекулярни резултати в значителни моменти от време, но не беше извършен централизиран морфологичен преглед на аспирата на костния мозък преди SCT.
По време на трансплантацията е получено съгласие за данните, които трябва да бъдат регистрирани в регистъра BSBMT за анализ на резултатите и изследванията, в съответствие с насоките на EBMT.
Трансплантация
Съвместимостта с HLA със свързан с възрастен или несвързан донор е дефинирана чрез типизиране с висока/средна разделителна способност за локуси на HLA-A, -B, -C, -DR, -DQ. Съвместимостта с HLA с несвързан кабел беше определена като типизиране с висока/средна разделителна способност за локуси на HLA-A, -B, -DR. Съвместимостта с HLA с донор на брат или сестра е дефинирана чрез типизиране с ниска разделителна способност за HLA-A, -B, -C, -DR, -DQ. Донорите са определени като идентични с HLA братя и сестри, ако са наследили същите родителски хаплотипове като техните реципиенти. Двойките донори-реципиенти бяха определени като HLA съвпадение (MD), ако те бяха 10/10 (възрастен донор) или 6/6 (кабел) и HLA несъответствие (MMD) в противен случай.
Режимите на кондициониране се определят като "намалена интензивност" съгласно критериите на Шамплин и миелоаблативно в противен случай. Накратко, режимът на кондициониране се счита за миелоаблативен, ако причинява необратима цитопения без спасяване на стволови клетки и с намалена интензивност, което води до обратима миелосупресия, свързана с ниски нива на нехематологична токсичност. 17
Проучете крайните точки
Първичната крайна точка на проучването е LFS 5 години след SCT при деца с първична рефрактерна или рецидивираща рефрактерна AML, трансплантирана в ремисия. LFS се определя като времето от трансплантацията до рецидив или смърт от каквато и да е причина, което от двете настъпи първо. Вторичните крайни точки включват честотата на остри и хронични GVHD, честота на рецидиви, TRM и 5 години OS. TRM се определя като всяка смърт, настъпила в Чешката република; OS се определяше като времето от SCT до смъртта, независимо от причината.
Статистически анализ
Данните за пациентите бяха събрани чрез базата данни BSBMT и проверени във всеки център. Данните бяха проверени за последователност и окончателният анализ беше извършен с помощта на статистическия софтуер на Stata (StataCorp. 2015. Статистически софтуер на Stata: Издание 14, College Station, Тексас: StataCorp LP) и R. Последващата актуализация беше актуализирана на 1 януари 2016 г. Резултати от описателни анализи са дадени като медиани и диапазони. За оценка на LFS и OS са използвани оценки на Каплан-Майер и интервали на доверие, а за сравнение са използвани log rank тест (дискретни променливи) и регресия на Cox. 18 пациенти са били цензурирани при последното проследяване, ако не са се случили събития. Изчислена е кумулативната честота на рецидив и TRM, което позволява конкурентни рискове, използвайки метода на Fine-Grey. 19 Прокс пропорционални регресионни модели на риск от Кокс са използвани за оценка на ефекта на следните променливи върху възрастта на рецидив, LFS и OS: възраст, цитогенетична рискова група, първичен срещу повтарящ се рефрактерен, процент на бласти в BM в SCT, режим на кондициониране, тип донор (използване срещу несъответствие).), използването на изчерпване на Т-клетките, източника на стволови клетки и наличието на остра и хронична GVHD. Доверителните интервали се отчитат при 95% и статистическите тестове са извършени при 0,05 (двустранно).
резултатът
Характеристика на пациентите
Шестдесет и един пациенти бяха идентифицирани чрез регистъра BSBMT като получатели на SCT за рефрактерни ОМЛ не в Чешката република в SCT между 2000 и 2012 г. Двама пациенти бяха изключени въз основа на диагнозата ювенилна миеломоноцитна левкемия и 15 пациенти бяха изключени като валидиране на данните. не потвърждава диагнозата рефрактерна AML. Анализирани са останалите 44 пациенти, за които проверката на източниците потвърждава рефрактерно заболяване. Характеристиките на 44-те пациенти, които са участвали в проучването, са обобщени в таблица 1.
Маса в пълен размер
Характеристики на трансплантацията
Маса в пълен размер
Процес след трансплантация
Таблица 3 обобщава резултатите от нашата кохорта след трансплантацията. Един пациент почина на ден +10 (септично събитие) и един ден +14 (прогресия на заболяването). От 42 оценими пациенти 39 са постигнали придържане (93%). Средното време до присаждането на неутрофили е 15 дни (диапазон 10-42). Двама пациенти са имали рецидив при присаждане (5%). Остър GvHD се съобщава при 23 пациенти (52%) и е тежък при осем пациенти (19%). Един пациент е имал ограничен и два екстензивни хронични GvHD, общата честота е 7%. GvHD се счита за причина за смърт при двама пациенти в нашата група.
Маса в пълен размер
резултатът
Девет пациенти са починали в Чешката република от причини, свързани с трансплантацията (две свързани с GVHD, една сърдечна токсичност, една гръдна инфекция с Aspergillus, един енцефалит, една CMV-свързана инфекция, един сепсис, един ендокардит, една аденовирусна пневмония). Пет от тези осем пациенти са починали преди ден + 100 след SCT. TRM на ден +100 и ден +365 е 11% (95% CI 4-23%) и 18% (95% CI 9-31%).
От 44 пациенти 30 (68%) са постигнали CR след SCT. Осемнадесет души живеят в Чешката република, а 5-годишният LFS в тази група е 43% (95% CI 28–57%) със средно проследяване от 6 години и 9 месеца. Седемнадесет пациенти рецидивират при средно време от 61 дни след SCT (диапазон 13 - 279) и всички умират от прогресия на заболяването. Един пациент с рецидив е влязъл в друг CR след последващо лечение, което е претърпяло втори SCT, след което той е рецидивирал и е починал поради прогресия на заболяването. Кумулативната честота на рецидив е била 32% след 5 години (95% CI 19-46%).
Анализ на подгрупите
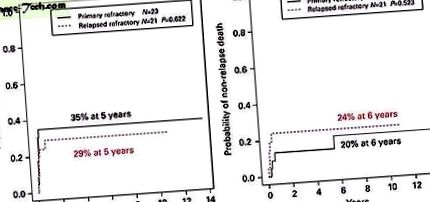
Рискът от рецидив и нерецидивираща смъртност са сходни при пациенти с първично рефрактерно и рецидивиращо рефрактерно заболяване (Фигура 1). В резултат на това 5-годишните LFS и OS при пациенти с първична рефрактерна AML (43% (CI 22-62%) и 43% (CI 22-62%)) се припокриват с пациенти с рецидивиращо рефрактерно заболяване (43% (CI 22 -62%)). –62%) и 43% (CI 22–62%)) (Фигура 2). По същия начин пациентите с неблагоприятна цитогенетика не се представят по-зле от пациентите със стандартна цитогенетика (кумулативна честота на рецидив 29% срещу 42%, P = 0,345). За разлика от тях, нито един от пациентите с благоприятен цитогенетичен профил не е рецидивирал след трансплантация (Фигура 3) и 5-годишният им LFS е 67% (CI 19–90%), въпреки че това не достига статистическа значимост поради малкия брой пациенти в такъв случай. (n = 6).
а ) Кумулативна честота на рецидив след SCT при деца с първична рефрактерна AML и деца с рецидивирала рефрактерна AML. ( б ) Кумулативна честота на нерецидивна смъртност след SCT за деца с първична рефрактерна AML и деца с рецидивираща рефрактерна AML. Пълноцветната версия на това изображение е достъпна в онлайн трансплантацията на трансплантация на костен мозък.
Изображение в пълен размер
а ) Преживяемост без левкемия след SCT за деца с първична рефрактерна AML и деца с рецидивирала рефрактерна AML. ( б ) Обща преживяемост след SCT за деца с първична рефрактерна AML и деца с рецидивирала рефрактерна AML. Пълноцветната версия на това изображение е достъпна в онлайн трансплантацията на трансплантация на костен мозък.
Изображение в пълен размер
Кумулативна честота на рецидив след SCT при деца с рефрактерна ОМЛ според цитогенетичната рискова група при диагностициране. Цитогенетични рискови групи според Swerdlow et al. 16 и Creutzig et al. 6 Пълноцветна версия на това изображение е достъпна в онлайн трансплантацията на трансплантация на костен мозък.
Изображение в пълен размер
Таблица 4 обобщава анализираните прогностични фактори за LFS, честотата на рецидиви и честотата на рецидиви на смъртността в нашата група. Регресионният анализ показа, че трансплантацията с процент на бласти по-висок от 30% при BM предсказва значително по-висок риск от рецидив (60% срещу 15%, P = 0,004), докато миелоаблативният прием и развитието на остър GVHD положително повлияват на резултата при група пациенти (Фигура 4а). Никакви други характеристики, свързани с трансплантацията (донор, източник на стволови клетки, изчерпване на Т-клетките) не повлияват дългосрочния резултат. Пациенти на възраст 10 години показват тенденция към повишена смъртност, свързана с трансплантацията (5% срещу 29%, P = 0,05).
Маса в пълен размер
а ) Преживяемост без левкемия при деца, които получават миелоаблативна стабилизация (MAC) и които развиват остра GVHD в сравнение с деца, които не развиват остра GVHD и които имат намалена интензивност на кондициониране (RIC). б ) Преживяемост без левкемия при деца на 10-годишна възраст, претърпели SCT с> 30% бласти в костния мозък в сравнение с всички останали пациенти в групата. Пълноцветната версия на това изображение е достъпна в онлайн трансплантацията на трансплантация на костен мозък.
Изображение в пълен размер
Чрез комбинирането на горните рискови фактори успяхме да идентифицираме група деца с много висок риск от рецидив. Пациентите на възраст 10 години с> 30% бласти в SCT се представят значително по-зле от останалата част от нашето население, което се оказва почти неоткриваемо (LFS 10% срещу 53%, P = 0,037, Фигура 4b).
дискусия
Въпреки че SCT често се използва за лечение на високорисков AML, неговата роля в контекста на химиотерапевтичното заболяване все още се обсъжда. Това проучване изследва ролята на SCT при педиатрични пациенти с рефрактерна AML и прогностични характеристики в това отношение. Нашата поредица показва, че SCT може да бъде лекуван при значителен брой деца, трансплантирани с активна AML, с 5-годишен VZPS от 43%. По-специално, ние показахме, че по-младите пациенти с ниска тежест на заболяването при SCT са постигнали забележителен LFS от 53%. Едно от основните ограничения на нашето проучване е, че естеството на регистъра изключва оценка на това колко случая на рефрактерни ОМЛ са били диагностицирани по време на периода на проучване в Обединеното кралство, пропускайки важна информация за това колко пациенти са били счетени за неподходящи за SCT или са починали по време на лечението. в очакване на SCT (изчисляваме, че приблизително 120 пациенти с рефрактерна ОМЛ са били диагностицирани в Обединеното кралство през периода на проучването). Това от своя страна води до значителна тенденция на подбор в нашата кохорта от пациенти.
В допълнение, 18 пациенти от нашата група са диагностицирани с рефрактерна болест на SCT въз основа на морфологична оценка само на BM без молекулярно или цитогенетично потвърждение. Докато морфологичната оценка включва известна степен на субективност, в това проучване честотата на рецидив при пациенти, диагностицирани с рефрактерно лечение, основаващо се единствено на морфологията, не е статистически различна от честотата на пациентите с молекулярно/цитогенетично потвърждение (честота на рецидиви 53% спрямо 30 %). P = 0, 1, CI 0, 8 - 6, 5).
В рамките на ограниченията на ретроспективното проучване на регистъра, нашите данни показват, че значителна част от децата с активна рефрактерна ОМЛ са лечими с SCT, особено тези с благоприятна цитогенетика, пациенти на възраст под 10 години и по-малко от 30% от бластите при BM при деца. SCT. Това проучване също така предполага, че режим на миелоаблативно кондициониране, както и стратегии за подобряване на GVL, могат да бъдат от полза в този контекст. Според нашите данни трансплантацията изглежда не предлага значителен шанс за излекуване на пациенти над 10-годишна възраст и експлозии> 30% при BM. Следователно тази група деца трябва да бъде внимателно оценена въз основа на фаза 1/ново лечение или проучвания за палиативни грижи в зависимост от тяхното клинично състояние и семейни наклонности.