- елементи
- абстрактно
- Въведение
- Пациент и методи
- Регистрация и вземане на проби от пациента
- Проучване и анализ на последователността
- Изследване на експресията на протеини
- Тест за броя на копията на Taqman
- резултатът
- Proband мечки мутация GPD1
- Хаплоинформация за GPD1 при пробанд и баща
- Дефицит на протеин GPD1 в проба от чернодробна тъкан
- дискусия
елементи
- Генетика на болестите
- Чернодробно заболяване
- Метаболитни нарушения
- мутации
абстрактно
Съставянето на клиникопатологични и лабораторни находки, включително масивна хепатомегалия, стеатоза и изразена хипертриглицеридемия в детска възраст, е изключително рядко. Описваме дете, което има горепосочените констатации и въпреки обширното диагностично изследване не е установена причина. Цялостното секвениране на exom беше извършено върху ДНК на пациент и родител. Идентифицирани са мутации в GPD1, кодираща глицерол-3-фосфат дехидрогеназа, която катализира обратимата редокс реакция на дихидроксиацетон фосфат и NADH до глицерол-3-фосфат (G3P) и NAD +. Proband наследява изтриването на GPD1 от бащата, както е определено чрез анализ на номера на копие и промяната в миссенс p. (R229Q) от майката. GPD1 протеин не присъства в чернодробната биопсия на пациента при Western blot. Ниска нормална активност на карнитин палмитоил трансферази, CPT1 и CPT2, присъства в кожните фибробласти на пациента, без мутации в гените, кодиращи тези протеини. Това е първият доклад за хетерозиготни мутации на съединение в GPD1, свързано с дефицит на протеин GPD1 и намалена активност на CPT1 и CPT2.
GPD1 (MIM 138420) кодира цитоплазмен NAD-зависим глицерол-3-фосфат дехидрогеназа 1 (GPD1), 349 аминокиселинен протеин с размер 37,5 kD, който катализира обратимата редокс реакция на дихидроксиацетон фосфат (DHAP) и NADH до глицерол-3 -фосфат.) и NAD +. 1, 2 GPD1 заедно с митохондриалния ензим, GPD2 също играе важна роля в транспорта на редуциращи еквиваленти от цитозола до митохондриите. 2 Наскоро е идентифицирана хомозиготна сплайсинг мутация в GPD1, c.361-1G> C, предвидена да кодира p.Ile119fsX94, при 10 членове на семейството от четири силно съюзени израелски арабски семейства, които показват ранна поява на хепатомегалия, чернодробна стеатоза и хипертриглицеридемия . 2
Моногенната хипертриглицеридемия се причинява от мутации в липопротеинова липаза (LPL), аполипопротеин C-II (APOC2), гликозил-фосфатидил-инозитол, закотвен от HDL-свързващ протеин (GPIHBP1), apoA-V (APOA51) и фактор 1 (LMOF). 2, 3, 4 Чернодробната стеатоза като моногенно заболяване в ранна детска възраст е изключително рядка и е описана при синдрома на Chanarin-Dorfman поради абхидролазен домен, съдържащ 5 (ABHD5) мутации и дефекти в окислението на митохондриалните мастни киселини, включително CPT1A, CPT2 и много много ацилна Дълговерижна CoA дехидрогеназа (ACADVL). 5, 6, 7 Тези пациенти често имат други характеристики, включително хипогликемия, енцефалопатия и кардиомиопатия, миопатия и чернодробна недостатъчност. Комбинацията от дълбока хипертриглицеридемия и тежка хепатомегалия в ранна детска възраст е изключително рядка.
Тук описваме кавказки пациент с масивна хепатомегалия, мастен черен дроб и тежка хипертриглицеридемия, носеща хетерозиготна мутация на съединението в GPD1 (MIM 138420). Това е първият случай на мутация на GPD1, идентифицирана извън израелското арабско население. Освен това показваме, че протеинът GPD1 липсва в чернодробната тъкан на пациента. Не е имало компенсаторно увеличение на нивата на GPD2 в отговор на дефицит на GPD1. Освен това, въпреки че активността на карнитин палмитоилтрансферазите CPT1A и CPT2 е намалена във фибробластите на пациента, не са идентифицирани мутации в тези гени и количеството CPT1A в проба от чернодробната му тъкан не се променя.
Пациент и методи
Регистрация и вземане на проби от пациента
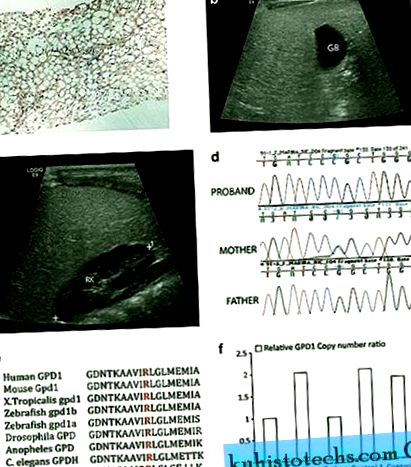
Радиопатологични и генетични находки в пробанд с мутация GPD1 . а ) Чернодробна биопсия: чернодробният паренхим показва макро- и микровезикуларни промени в мазнините върху оцветяването на хематоксилин и еозин (H&E), увеличение × 10 ( б а ° С ) Ултразвукът демонстрира дифузна хиперехогенност на черния дроб с фин гранулиран модел. За сравнение, жлъчен мехур (GB) ( б ) и десен бъбречен паренхим (RK) ( ° С ) са хипоехогенни. д ) Анализът на ДНК последователността на PCR геномни продукти илюстрира три генотипа за GPD1 c.686G> C, наблюдавани в семейство с хомозиготен пробанд, хетерозиготна майка и WT баща за алела. д ) Промененият остатък на аргинин (червен) е еволюционно добре запазен в протеини GPD1 и GPD1L при гръбначни животни и по-ниски организми, включително дрожди. ( е ) Относителните нива на експресия на GPD1, използвайки анализ на номер на копие, разкриват, че бащата и пробандът са хаплоинергии на GPD1 спрямо майката и две контроли.
Изображение в пълен размер
Probanda (0091-01) и нейните родители (0091-02 и 0091-03) бяха включени в одобрено от IRB проучване, проведено от Gene Discovery Core в Центъра за изследване на сираци в Мантон, докато бяха хоспитализирани в детската болница в Бостън (BCH) ).). Взети са кръвни проби и са обработени за екстракция на ДНК с помощта на Research Connection Biobank Core в BCH. Останалата тъкан от диагностичната чернодробна биопсия е взета за допълнителни молекулярни анализи.
Проучване и анализ на последователността
ДНК от пробанд и от двамата биологични родители е изпратена за секвениране на цели екзоми (WES) до Axeq Technologies, Rockville, MD, САЩ. Пробите бяха подготвени като библиотека за секвениране на Illumina и обогатени за екзомични последователности, използвайки протокола за обогатяване на Exlum Enlumina. Заловените библиотеки бяха секвенирани с помощта на Illumina HiSeq 2000 Sequencers. Показанията бяха картографирани към набор от човешки UCSC hg19 геноми, използвайки Burrow-Wheeler Alignment (версия 0.5.8). Еднонуклеотидни полиморфизми (SNP) и малки вмъквания/делеции бяха наречени SAMtools (версия 0.1.7). Вариантите или SNP бяха филтрирани с помощта на NHLBI екзомен сървър за варианти (//evs.gs.washington.edu/EVS/) и бази данни dbSNP Build 137.
PCR се извършва за амплифициране на кандидат-гена (GPD1), използваната референтна последователност е GPD1; NG_032168.1, NM_005276.3. Варианти, идентифицирани в GPD1, са изпратени в базата данни на Leiden Open Variant Database (LOVD) //databases.lovd.nl/shared/genes/GPD1.
Използвани са следните праймери: GPD1_1F: AGGAGGGGTCTTTTCTCAC и GPD1_1R: ATCAGGTCAGCAACACCACA и получената амплифицирана ДНК е изпратена до Sanger Sequencing. Резултатите бяха анализирани с помощта на софтуера Sequencer 5.0 и сравнени с последователността на гена от див тип (WT). Праймерите също са проектирани да последователстват различни SNPs в съседство с GPD1. SNP включени: rs836180, rs200359712, rs201128732, rs2640533, rs147189770, rs10875996, rs4898546, rs7139363, rs836170, rs836171, rs113783111, rs836177, rs10783334, rs7964522, rs112386170, rs7964698, rs10735822, rs71464996, rs71441320, rs55639096 и rs12229758.
Изследване на експресията на протеини
Western blot беше извършен за измерване на нивата на GPD1, GPD2 и CPT1A в чернодробни тъканни проби, достъпни от пациента, и контрола в сравнение с възрастта. Тъканта се съхранява при -80 ° С до анализ. Прехвърлените протеини бяха тествани с антитела срещу GPD1 (HPA044620, разреждане 1: 200, Sigma-Aldrich, Сейнт Луис, МО, САЩ), GPD2 (Ag11036, разреждане 1: 2000, Proteintech, Чикаго, IL, САЩ), CPT1A ( (Ag7202, 1: 500 разреждане, Proteintech, Чикаго, IL, САЩ) и GAPDH (FL-335 разреждане, 1: 1000 разреждане, Santa Cruz Biotechnology, Santa Cruz, CA, USA) като контрол и визуализиран чрез засилена хемилуминесценция. Стандартизиран за GAPDH с използване на том One 4.2.1 (Bio-Rad Laboratories, Inc., Hercules, CA, USA) на Image Station 440 (Kodak DS; Eastman Kodak Co., Rochester, NY, USA).
Тест за броя на копията на Taqman
Анализът на броя на копията на Taqman (Life Technologies, Woburn, MA, USA) беше извършен върху ДНК от пробанди, родители и две контроли. Сондите за GPD1 (Hs00911535_cn, маркиран с FAM) и референтен номер на копие (4403326, RNase P (RPPH1) с етикет VIC) се предлагат на пазара. Тестът се повтаря два пъти и се извършва в три екземпляра. Двадесет нанограма (1 μl) ДНК бяха използвани за ямка с 12 μl Taqman Universal PCR master mix (Applied Biosystems, Woburn, MA, USA) и 1 μl от всяка от специфичните сонди (цел и контрол). За интерпретиране на резултатите е използвана 7300 PCR система в реално време от Applied Biosystems за извършване на PCR софтуер и Sequence Detection v1.4. ДНК амплификацията на базата на амплификационни графики беше сравнена и бяха получени средни прагове на цикъла (Ct). Промяната в сгъването в броя на копията на целевите и референтните гени, нормализирана към контролата, беше изчислена, като се използва относително количество = 2 - A Ct .
резултатът
Proband носи мутацията GPD1
WES беше извършен върху ДНК проби от триото (биологични родители и пробанд). Пробандът носи хомозиготна мутация c.686G> C в гена GPD1, за който се смята, че причинява промяна в аминокиселините p (R229P). Последователността на Sanger потвърждава мутацията (Фигура 1d) и в същото време изследователска група в Онтарио, независимо получена от генния анализ на кандидат, получава същия резултат (лична комуникация от Робърт Хегеле). Този остатък е еволюционно запазен (Фигура 1д) и мутацията не присъства в никоя от публично достъпните бази данни за SNP, докато c.686G> Потенциално причиняваща промяна в р (R229Q) е идентифицирана в 1/13 005 хромозоми (честота 28 е 1, което е в съответствие с мутация, която е вероятно да повреди, а анализът на SIFT 9 разкрива, че тази промяна не е потенциално толерирана. Интересно е, че въпреки че майката е мутирала хетерозиготно, бащата очевидно е хомозиготен за алела WT. в същия локус, който е наследил пробанда, или може да прояви еднородна дисомия за майката алел.
Хаплоинформация за GPD1 при пробанд и баща
Извършен е тест с номер на копие на Taqman върху трио и две контролни ДНК проби, за да се оцени дали бащата и пробандът са хаплоинергични при GPD1. Нишката на последователността, използвана за проектиране на сондата Taqman Hs00911535_cn, съдържа мутантния локус GPD1 c.686 (Chr 12: g. 50, 501, 423). За референция беше използвана сонда 4403326 за RPPH1. Забелязване на GPD1 се наблюдава в пробанда и бащата е индикиран от наличието на едно копие в сравнение с двете копия, налични в майката и две контроли (Фигура 1f). Подозираме, че заличаването е> 1,85 kb, както при друг локус GPD1 (rs836180, Chr 12: g. 50, 503, 269), бащата очевидно е хомозиготен за SNP, докато и пробандът, и майката са хомозиготни за WT алел. За да оценим дали делецията включва гени, съседни (5 'и 3') на GPD1, генотипирахме няколко известни SNP, открити в гените SMARD1 и COX14. Много от тези SNP бяха информативни и нямаше доказателства за тяхното заличаване. Въз основа на местоположението на геномните координати приемаме, че заличаването е по-малко от 28,7 kb. В заключение пробандът е хетерозиготен за две мутации на GPD1, които носят делеция от бащата и забавяне от майката.
Дефицит на протеин GPD1 в проба от чернодробна тъкан
За да се оценят ефектите от тези мутации, от патологичния отдел са взети проби от чернодробна биопсия и контрол на възрастта и пола. GPD1 антитялото се използва за тестване на протеина GPD1. В контролата, съответстваща на двете изоформи GPD1, бяха идентифицирани две ленти с молекулни тегла от 37,5 kD (изоформа 1) и 35 kD (изоформа 2) (Фигура 2). Интересното е, че изоформа 1 е силно изразена в контролата, но липсва при пациента. За сравнение, изоформа 2 се изразява в малки количества в контролните проби, докато при пациента е леко увеличена. Подозираме, че в случай на изоформа 1, мутацията c.686G> Missense може да повлияе на сплайсинга, създавайки отклоняваща се транскрипция, която претърпява разграждане, медиирано от глупости. Освен това, лекото увеличение на изоформа 2, наблюдавано при пациента, може да е вторично в сравнение с дефицита на изоформа 1.
Western blot анализ върху чернодробна биопсия от пробанд и контрола, сравнима с възрастта. GPD1 протеин липсва в пробанда, въпреки че подобни количества GPD2 и CPT1A присъстват в пробанда и контрола.
Изображение в пълен размер
Нивото на GPD2, митохондриалната изоформа, беше сравнено, за да се определи дали се е променило в отговор на дефицит на GPD1. Тествахме GPD2, използвайки специфично антитяло и пробандът не показа никаква промяна в нивата на GPD2.
Активността на ензимите CPT1 и CPT2 е намалена в култивирани кожни фибробласти от пробанда, но секвенирането на двата гена не идентифицира патогенна мутация. Тествахме количествата на CPT1 A, чернодробна изоформа на CPT1 в черния дроб чрез Western blot и не открихме значителна разлика между пациента и контрола.
дискусия
За първи път съобщаваме за пациент, който е наследил две хетерозиготни мутации на GPD1, изтриване и промяна в забавянето. Нашите проучвания убедително показват, че тези две мутации са довели до дефицит на GPD1. От ранна детска възраст пациентът е имал FTT, повръщане, тежка хепатомегалия и хипертриглицеридемия. Клиничните находки са много сходни с 10 индивида от четири израелски арабски семейства, носещи хомозиготна основополагаща мутация c.361-1G> C в GPD1, които са имали повръщане, FTT, увеличен черен дроб и хипертриглицеридемия на гладно (TG 258-6244 mg)./dl). 2
GPD1 е член на NAD-зависимото семейство GPD. Той играе основна роля в липидната биосинтеза чрез превръщане на DHAP в G3P, който от своя страна се дефосфорилира до глицерол, последван от ацилиране с мастни киселини, за да се образуват ацилглицеролови видове. DHAP, междинен продукт на гликолиза, може да не се преобразува в G3P поради дефицит на GPD1, причинявайки относително излишък на DHAP и намаляване на G3P. В миши модел на дефицит на GPD1, концентрациите на DHAP са значително по-високи и G3P по-ниски в сравнение с нивата при чернодробни, мускулни и бъбречни WT мишки. Механизмът на затлъстяването на черния дроб при нашия пациент може да се дължи на ацилиране на излишния DHAP. Пътят на ацил-DHAP вече е описан, където DHAP може първо да бъде ацилиран и след това редуциран до 1-ацил-sn-G3P. 11, 12 Известно е, че ацилният DHAP път играе важна роля в синтеза на глицеролипиди в черния дроб на мишка. 12
Активността на CPT1 и CPT2 е ниско нормална във фибробластите на пациента, но не са установени мутации в гените CPT1A и CPT2. Освен това не е имало намаляване на количеството CPT1A протеин в черния дроб. Подозираме, че намаляването на активността на CPT1 и CPT2 може да е вторично вследствие на натрупването на DHAP и/или неутрална мазнина в цитоплазмата. Известно е, че Malonyl CoA, междинен продукт в биосинтеза на мастни киселини de novo и удължаването на мастните киселини, алостерично инхибира CPT. 13
Диагнозата на дефицит на GPD1 оказа значително влияние върху управлението на пациентите. Чернодробната трансплантация, по-рано разглеждана, не се препоръчва след молекулярна диагноза. Това се основава отчасти на резултатите при пациенти с мутация на GPD1. 2 Най-старият пациент в кохортата от мутанти, носещи сплайсинг GPD1 от Близкия изток, е на 23 години и е асимптоматичен. Освен това при осем от десетте засегнати пациенти нивата на триглицеридите намаляват с течение на времето.
В заключение, дефицитът на GPD1 е дефект в глюкозните и липидните пътища, свързани с тежка хипертриглицеридемия и NASH. WES предостави диагноза в този случай, когато обширни клинични изпитвания не идентифицират причината. Молекулярната диагностика предоставя предварителна информация на семейството и води клинично управление. Въпреки че развитието е подходящо в този момент, този пациент ще се нуждае от внимателно наблюдение, тъй като дефицитът на GPD1 може да повлияе на махалото на глицерол фосфата и не позволява на определени клетки да извличат цялата си енергия от гликолиза, особено в мозъчните клетки, на които не се разчита напълно. разтвор на солат от малат и аспартат за доставяне на цитозолни редуциращи еквиваленти в митохондриалната матрица.
- Диетичната сол кара МС да прогресира до Болест 2021
- Elle Какво причинява това и защо се нуждае от незабавно лечение - Ygeia 2021
- Хепатомегалия, причинява разширяване на черния дроб - Болести 2021
- Ена и любовницата й убиха сина си († 9) След като бяха намушкани, те искаха да го скарат!
- Лечебна вода Ferenc József с Glauber и гореща сол 700 мл