елементи
абстрактно
Предишни проучвания показват, че много неблагоприятни фактори на околната среда по време на пренаталния живот могат да повлияят на развитието на заболявания на възрастни (напр. Хипертония, захарен диабет и т.н.). 1, 2, 3 Редица пренатални обиди (напр. Никотин, хипоксия, диета с ниско съдържание на протеини и др.) Могат да „програмират“ определени сърдечно-съдови проблеми и да увеличат податливостта към сърдечно-съдови заболявания в по-късна възраст. 3, 4, 5, 6 Доказано е, че прекомерната консумация на захароза по време на бременност води до затлъстяване и непоносимост към глюкоза при малките, както и до хипертония и при двата пола 1 и може да бъде свързана с инсулинова резистентност и хипергликемия при плъхове. Пренаталната диета с високо съдържание на захароза (HS) може също да бъде отговорна за редица неблагоприятни ефекти върху развитието на плода. Основните механизми, които допринасят за развитието на хипертония при потомство, изложено на високо ниво на захар, са неясни.
Когато се прилага на плъхове по време на бременност, е доказано, че каптоприл, инхибитор на ангиотензин конвертиращия ензим, предотвратява развитието на хипертония, програмирана от нискобелтъчна диета на майката, което предполага ключова роля на ренин-ангиотензиновата система (RAS) в развитието. хипертония. В допълнение, специфичен антагонист на AT1 рецептор (AT1R), лозартан, може да елиминира повишаването на кръвното налягане (BP) в резултат на експозиция на майки с нископротеинова диета при плъхове, което предполага, че ангиотензин II (Ang II), критичен хормон в регулацията на сърдечно-съдовата хомеостаза, играе важна роля в пренаталното програмиране на хипертония. В това проучване изследвахме налягане, реагиращо на BP и Ang II при потомство, изложено на пренатална висока захар.
Ang II може да стимулира вазоконстрикцията по три основни начина: чрез освобождаване на Ca 2+ от вътреклетъчните запаси, чрез трансмембранен приток на Ca 2+ предимно през L 2 тип Ca 2+ канали (Ca v 1.2) и чрез активиране на една или повече протеинкиназа C ( PKC) изоформи. Доказано е, че PKC увеличава вътреклетъчния Са 2+ чрез активиране на Са в 1, 2, което от своя страна предизвиква вазоконстрикция. Нашето предишно проучване показа, че прекомерната консумация на захар по време на бременност води до повишен съдов отговор на Ang II. 12 Уайт и др. 13 показа, че повишената чувствителност на мезентериалните артерии от стрептозотоцин-диабетни плъхове към алфа-адренергични агонисти е по-зависима от извънклетъчния калций. Други лаборатории са показали, че аортните гладкомускулни клетки от миши модел на диабет тип 1 показват увеличение на Ca ток при 1, 2. Следователно, това проучване е предназначено да тества дали PKC/Cao 1.2 пътът допринася за повишен Ang II- медиирана реакция на натиск и вазоконстрикция при HS потомство.
методи
Бременни плъхове Sprague-Dawley от Университетския център за животни Soochowski бяха настанени в контролирана среда при 22 ° C с 12 h цикъл светлина/тъмнина. Те бяха разделени на случаен принцип в две групи: (1) контролната група беше хранена със стандартна диета и (2) HS групата беше снабдена със същата храна и 20% разтвор на захароза от ден 1 на бременността. чешмяна вода и стандартна храна за плъхове за 5 месеца. Всички процедури бяха одобрени от Институционалния комитет за грижа за животните и бяха в съответствие с Наръчника за грижа и употреба на лабораторни животни.
Измерване на кръвната захар и телесното тегло
Бременни плъхове (на 21-ия ден от бременността), както и мъжки възрастни потомци на 5-месечна възраст са упоени със смес от кетамин (75 mg kg-1) и ксилазин (10 mg kg-1; Hengrui Medicine, Jiangsu, China) прилага интраперитонеално. Взети са фетални кръвни проби след обезглавяване. Взети са кръвни проби от майка и потомство от коремната аорта. Взети са кръвни проби в ледено студени пластмасови епруветки, съдържащи хепарин. Кръвната глюкоза се определя с помощта на анализатор Nova (Nova Biomedical, Waltham, MA, USA) и се измерва телесното тегло.
BP измерване
Потомството е имплантирано в бедрените им артерии с катетър, за да регистрира BP, както е описано. След 3 дни възстановяване след операция, BP се измерва непрекъснато при плъхове в съзнание и в свободно движение След основния запис през
Ang II (100 ng kg-1; Sigma, Сейнт Луис, Калифорния, САЩ) 16 в 0,2 ml физиологичен разтвор се инжектира интравенозно през катетъра в продължение на 60 минути и BP се записва за допълнителни 120 минути с помощта на Power устройство. -Лабораторна система и софтуер (AD Instruments, Bella Vista, Нов Южен Уелс, Австралия).
Измерване на съдов тонус
Малки сегменти от мезентериални артерии (клон от четвърти ред) бяха изолирани в разтвор на Krebs - Henseleit (mmol -1: NaCl 115, NaHCO 3 25, KCl 4, 6, NaH 2 PO 4 1, 2, MgCl 2 1, 2, CaCl 2 2, 5 и глюкоза 10). рН 7, 4 и монтирани в мултимиографска система (Danish Myo Technology, Централна Ютландия, Дания), поддържана в кислороден разтвор на Krebs-Henseleit (95% O 2, 5% CO 2) при 37 ° C. 17, 18 След уравновесяване за 60 минути, съдовите пръстени се свиват с кумулативно нарастващи концентрации на Ang II (10-11-10-5 mol-1). Лосартан (AT1R антагонист, 10 μmol l -1), 19 PD123319 (AT2R антагонист, 10 μmol l -1), 19 GF109203X (PKC антагонист, 1 μmol l -1) 20 или нифедипин (Cav 1, 2, 10 μmol l антагонист ) - 1) 21 бяха използвани за предварителна обработка на сегментите в продължение на 30 минути преди прилагане на Ang II. Кривите на кумулативна концентрация-отговор на PKC активатор, phorbol 12, 13-дибутират (PDBu, 10 - 9 - 10 - 5 l - 1) или KCl (20 - 140 mmol l - 1) бяха извършени както в отсъствието, така и в присъствието на нифедипин в мезентериалните артерии. Тонът на съда се нормализира чрез максималното свиване, индуцирано от 60 mmol-1 KCl или от максималния отговор на съда към специфичен агонист. Всеки контейнер е използван само веднъж. Сигналите са записани с помощта на Power-Lab система със софтуер Chart 5 (AD Instruments, Castle Hill, NSW, Австралия).
Изолиране на съдови миоцити
Миоцитите са изолирани ензимно от отделни мезентериални артерии. 22 Съдове бяха нарязани на ленти от 1 mm в ледено студен разтвор (PSS), съдържащ (mmol-1) 137 NaCl, 5.6 KCl, 1 MgCl 2, 0.42 Na 2 HPO 4, 0.44 NaH 2 PO 4, 4.2 NaHCO 3 и 10 HEPES (рН 7, 4). Всички ензимни разтвори съдържат 1 mg ml-1 говежди серумен албумин. Изолираните съдови гладкомускулни клетки се получават чрез нежно разпрашаване в PSS. Клетките се съхраняват при 4 ° С за изследване в продължение на 6 часа.
Електрофизиологично измерване
Миоцитите се поставят директно на дъното на експерименталната камера и се визуализират с помощта на обърнат микроскоп (OLYMPUS CKX41, Токио, Япония). Клетките се измиват с разтвор за баня, за да се отстранят примесите. Пач пипетите бяха изтеглени от тънкостенни стъклени капиляри с помощта на лента за микропипети (Модел P-30, Sutter Instruments, Novato, Калифорния, САЩ). Съпротивлението на върха на пластирната пипета е 3 x 4 MΩ, когато се напълни с вътрешния разтвор на пипетата.
Затягането на напрежението на цялата клетка е извършено с помощта на компютърно контролирана система за затягане на ток и напрежение (Multiclamp 700B, Digidata 1440, Axon Instruments, Foster City, CA, USA), задвижвана от Clampex 10.1 и Multiclamp Commander 1. Отстраняване на пипетата и цяла клетка капацитетът се компенсира по електронен път. Потенциалът на клетъчната мембрана се измерва в беззъберен режим в конфигурацията на токова клема на цялата клетка и целият ток на клетката се измерва в режим на епизодично стимулиране в конфигурацията на клемата за напрежение на цялата клетка, използвайки усилвател Axonpatch 700B и Clampex 10.1. клетъчните токове бяха нормализирани с капацитет на клетката, за да се получи плътност на тока.
Western blot анализ
Наличието на PKC α, δ и Cav 1.2 α1 c-субединични протеини в мезентериалните артерии се измерва чрез Western blot анализ, нормализиран на β-актин. 23, 24 Първични антитела са кози поликлонални антитела (Santa Cruz Biotechnology, Santa Cruz, CA, USA) срещу Ca субединици в 1.2 и 1 c-субединици (1: 200), заешки поликлонални антитела (Santa Cruz Biotechnology) срещу PKCa (1: 200) или PKCδ (1: 200). Вторичното антитяло е магарешко анти-козе антитяло (1: 4 000) или козе анти-заешко антитяло (1: 4 000; Beyotime Biotechnology, Jiangsu, Китай). Имуносигналите се визуализират, като се използва хемилуминесцентна детекция (Amersham Biosciences, Piscataway, NJ, USA) и UVP система за изображения (EC3-Imaging-System, Upland, CA, USA). Образните сигнали бяха цифровизирани и анализирани и след това беше получено съотношението на интензивността на лентата към β-актина, за да се определи количествено нивото на относителна експресия на протеин.
Анализ и статистика
Данните са изразени като средно ± sem Сигнал (P 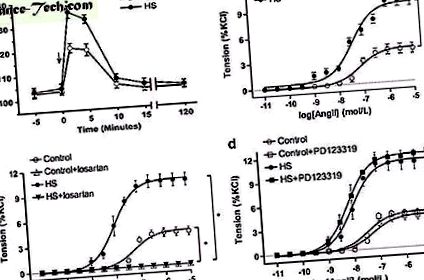
( а ) Анг II-медиирани реакции на натиск при потомството. Стрелка: интравенозно време на инжектиране Ang II. Контрол (n = 10 от пет язовира), HS: висока захароза (n = 12 от пет язовира). ( б ) Ang II-медиирана вазоконстрикция в мезентериалните артерии на потомството (n = 5, всяка група). ( ° С, д ) ефект на лозартан или PD123319 върху Ang II-медиирана вазоконстрикция в мезентериалните артерии на потомството (n = 5, всяка група). * Р
( а, б ) Ефект на GF109203X или нифедипин върху Ang II-медиирани вазоконстрикции в мезентериалните артерии на потомството (n = 5, всяка група). ( ° С, д ), PDBu и KCl-индуцирана вазоконстрикция при липса и наличие на нифедипин в мезентериалните артерии на потомството (n = 5, всяка група). Данни v д са изразени като процент от максималния отговор на този съд на KCl. * P # P
( а, б ) представителни следи от потоци Cao 1.2, записани от контролни и HS клетки. ( ° С ) Графики I - V показват повишен вътрешен ток при +10 mV до +50 mV в HS клетки (n = 20) в сравнение с контрола (n = 25). * P 0, 05). V1/2 инактивиране настъпи при -9,00 ± 1,29 mV за контрол и -6,24 ± 1,13 mV за HS клетки (P> 0,05). Няма значителна разлика между контролните и HS клетки в зависимостта на напрежението на активирането и инактивирането на Са в 1.2 (Фигура 4).
( а, б ) Типични инактивационни токове, получени на стъпки от +20 mV за 200 ms след прилагане на серия от 1000-ms потенциали за кондициониране от -60 до +60 mV. ( ° С ) Зависимост на напрежението на кривите на активиране на Ca токове в 1, 2 в контрола (n = 15) и HS клетки (n = 11) (G, проводимост; G max, максимална проводимост). ( д ) Зависимост на напрежението на кривите на инактивиране на Ca токове в 1, 2 в контролни групи (n = 22) и HS (n = 19) (I, ток; I max, максимален ток). Типични следи от активиращи токове са показани на фигура 3 ( а ) ( б ).
Изображение в пълен размер
PKC a, 5 изоформи и експресия на Cao 1.2 и 1 c в мезентериални артерии
Western blot анализът не показва значителна разлика в нивата на експресия на α1c Cao 1.2 субединиците и PKC8 изоформата в мезентериалните артерии между HS и контролната група. По-висока експресия на PKCα изоформата е открита при HS потомство (Фигура 5).
Експресия на PKC a, 8 изоформи и Cao 1.2 и 1 c субединици в мезентериалните артерии на потомството (n = 5, всяка група). * P 9, 25 и PKC/Ca в 1.2 са критични при вазоконстриктивни реакции и реакции под налягане. Ang II се свързва с AT1R, за да активира фосфолипаза С и след това хидролизира мембранните фосфоинозитиди до диацилглицерол, за да активира ПКК. 26, 27 PKC може да активира Cav 1.2 чрез директно фосфорилиране 28 или чрез промяна на мембранния потенциал чрез инхибиране на BK канали. Активирането на Са в 1.2 може да доведе до извънклетъчен приток на Са 2+ и вазоконстрикция.
Прекомерната консумация на захар по време на бременност може да доведе до свръхекспресия на AT1R в потомството. В това проучване лозартан, специфичен антагонист на AT1R, премахва повишения съдов отговор на Ang II в групата на HS, докато AT2R блокерът PD123319 не показва значителни ефекти върху Ang II-медиирани контракции, което предполага, че AT1R, а не AT2R, медиира Ang II -подобрена вазоконстрикция и реакция на натиск при ХС потомство. Диетата с високо съдържание на захар по време на бременност може да промени нивата на кръвта и хормоните, включително нивата на глюкоза и инсулин. Известни са взаимодействия между RAS и други ендокринни системи, свързани с хомеостазата на глюкозата. В предишно проучване хипергликемията регулира компонентите на RAS, необходими за синтеза и действието на Ang II, което може да допринесе за хипертония, свързана с метаболитен синдром. Поради това е разумно да се предположи, че биохимичните и ендокринните промени след предозиране на пренаталната захар могат да причинят промени в RAS при потомството. Също така установихме, че GF109203X потиска усилената с Ang II вазоконстрикция, което предполага, че подобрените PKC функции играят роля в ангиноконстрикцията на Ang II-стимулирана вазоконстрикция в потомството на HS. Като компонент нагоре по веригата на Ang II, свръхекспресираният AT1R може да допринесе за подобрена PKC функция.
Гестационният захарен диабет може да доведе до повишена активност и повишено разпределение на няколко PKC изоформи в ранната тъканна органогенеза, а хипергликемията може да увеличи PKC активността по различни in vitro проблеми. 32, 33, 34 изоформи на PKC, включително PKCα, PKCy, PKC8, PKCɛ и PKCζ, бяха открити в мезентериалните артерии на плъхове. Изглежда само α и δ изоформите участват в PDBu-индуцираната вазоконстрикция. PKCa може да засили Ca 2+-зависимата клетъчна контракция и свръхекспресията му е свързана с хипертония. Това проучване измерва експресията на PKCα и PKCδ, за да се определи дали те са участвали в подобрена PKC функция. В допълнение, PDBu се използва за тестване на PKC активност. Свръхекспресията на PKCα, а не PKCα, е установена при потомство с HS. Към днешна дата е доказано, че пренаталната хипоксия предизвиква епигенетично програмиране на гена PKCɛ в сърцето на плъх. По този начин епигенетичните фактори могат да бъдат един от основните механизми на промяна в PKCα, област, която заслужава допълнително проучване. PDBu произвежда по-голяма вазоконстрикция при потомство с HS. В допълнение, нифедипин обърна PDB-усилената вазоконстрикция, което предполага, че промененият път на PKC/Cao 1.2 може да допринесе за повишен Ang II съдов тонус.
В заключение, експериментите с микросъдове и клетки предполагат потенциални пътища, които могат да бъдат свързани с повишена активност на PKC/Ca в 1.2 и са свързани с промени в AT1R, PKCa и Ca в 1.2. Тези наблюдения могат да предоставят нови прозрения за механизмите, залегнали в отговор на усилената Ang II реакция и съдовия тонус при потомството, изложено на пренатално висока захар. Тази информация е важен принос за разбирането ни за ранната профилактика или лечение на сърдечно-съдови заболявания, които са програмирани вътреутробно .
- Гранули за кучета, съдържащи месо - Gosbi
- Филмовите звезди, в радостно очакване на съвета, съобщават новината за бременността си с нестандартни
- Словашките пациенти не искат да спазват диети - Начало - Новини
- FitKao - единствената какаова напитка за протеинова диета 300 g
- Пресни плодове с ниско съдържание на захар
