абстрактно
Този преглед постулира и представя скорошни доказателства, че инсулиновата резистентност се инициира в мастната тъкан, а също така предполага, че мастната тъкан може да играе ключова роля за индуциране на инсулинова резистентност в мускулите и черния дроб. Значителни нарушения в интрацелуларната инсулинова сигнална каскада присъстват в мастните клетки на пациенти с диабет тип 2, включително намалена експресия на IRS-1 гена и протеина, нарушена стимулирана от инсулина активност PI3-киназа и активност на PKB/Akt. За разлика от това, сигнализирането за инсулин нагоре по веригата в скелетните мускули от индивиди с диабет показва само леко увреждане и активирането на PKB/Akt in vivo от инсулина изглежда нормално. Въпреки това, стимулираният от инсулин транспорт на глюкоза и синтеза на гликоген са значително намалени.
Подобни изразени нарушения в инсулиновата сигнализация, включително намалена експресия на IRS-1, нарушена стимулирана от инсулин активност на PI3-киназа и активност на PKB/Akt се наблюдават и при някои (∼ 30%) нормогликемични индивиди с генетична предразположеност към диабет тип 2. GLUT4 е значително намалено в тези клетки, което е подобно на наблюдаваното в клетките на диабета. Хората с намалена клетъчна експресия на IRS-1 и GLUT4 също са значително устойчиви на инсулин и проявяват няколко характеристики на синдрома на инсулинова резистентност.
По този начин се наблюдава „диабетичен“ модел и при мастните клетки при нормогликемични субекти, което се свързва с подчертана инсулинова резистентност in vivo. Смята се, че инсулиновата резистентност и/или нейните ефектори се инициират в адипоцитите и че това може да е вторично за други инсулинови целеви тъкани, включително нарушен транспорт на глюкоза в мускулите.
Оценката на чувствителността на цялото тяло към инсулина и действието на евгликемичния метод е основно отражение на разграждането на глюкозата от мускулите (60–70%). Мастната тъкан представлява само% 10% от усвояването на глюкоза в цялото тяло и liver 30%. Намаленият инсулин-стимулиран глюкозен клирънс по време на евгликемична скоба се дължи главно на намалено усвояване на мускулна глюкоза. Това доведе до екстраполация, че инсулиновата резистентност на цялото тяло се появява не само в мускулите, но и в мускулите. Това е неоправдана екстраполация, която може да ни доведе до неправилно търсене на патогенни механизми.
Животински модели, както трансгенна свръхекспресия, така и генни нокаути, ни предоставиха вълнуващи прозрения за фенотипните последици от специфичната свръхекспресия или аблация на гени. Аблацията на гени на важни докинг протеини IRS-1 и IRS-2 произвежда забавени в растежа и подчертано устойчиви на инсулин (IRS-1) 2 или инсулиноустойчиви и диабетни животни с нарушена секреция на инсулин (IRS-2). 3 Мускулно-специфичната аблация на GLUT4 води до инсулинова резистентност4, но подобно на генокотичен glut4-специфичен нокаут, всъщност на това, което изглежда подобно. Това откритие очевидно не съответства на важната роля на мастната тъкан за елиминиране на глюкозата в тялото. Друга интересна констатация при животински модели е, че изчерпването на мускулите на GLUT4 е свързано с значително увеличаване на усвояването на глюкоза и увеличаване на мастната маса на мастната тъкан. Тази връзка между кръстосаните тъкани поддържа възможността инсулиновата резистентност да бъде инициирана в една тъкан, последвана от поредица от събития в други тъкани/органи.
Този кратък преглед обобщава последните ни открития при хора, които показват, че инсулиновата резистентност и нарушеното инсулиново действие се появяват първоначално в мастната тъкан; всъщност много преди да се развие непоносимост към глюкоза. След това се спекулира, че мастната тъкан може да инициира и/или да бъде първоначалният целеви орган за инсулин, където се развива инсулинова резистентност. Ще бъдат изследвани неотдавнашни данни, където инсулиновата сигнализация и ефект са изследвани в човешки целеви тъкани при инсулинорезистентни състояния, особено при диабет тип 2. Тъй като практически нищо не се знае за сигнализирането на инсулина зад инсулиновия рецептор в човешкия черен дроб, може да се направи сравнение само между скелетните мускули и мастните клетки.
Диабет тип 2
Наскоро беше изследван ефектът на инсулина, вложен ин виво или добавен ин витро, върху транспорта на глюкоза и инсулиновата сигнализация в скелетните мускули от пациенти с диабет тип 2. Най-значимите открития са нарушено стимулирано с тирозин стимулирано с инсулин фосфорилиране на IRS-1, което е свързано с 50% намаляване на активността на PI3-киназата. Обаче, активирането надолу по веригата на важната серин/треонин киназа PKB/Akt изглежда нормално или само в присъствието на супрапизиологична концентрация на инсулин, добавен in vitro. Нарушеното фосфорилиране на тирозин изглежда не се дължи на намалена експресия на IRS-1 протеин, въпреки че са наблюдавани по-ниски нива при гестационен диабет в някои клетки. Повишеното сериново фосфорилиране на IRS-1 може да намали стимулираното от инсулин фосфорилиране на тирозин, но понастоящем не е известно дали случаят е такъв при диабет тип 2. Като цяло данните показват, че активирането на PI3-киназа и вероятно PI3, 4- и фосфатното генериране на PI3, 4, 5, е намалена, но все пак достатъчна, за да позволи нормално активиране на сигнални събития надолу по веригата. Това доведе до заключението, че инсулиновата резистентност в скелетните мускули се дължи на нарушено активиране на ефекторни или сигнални молекули от PKB/Akt. 8
Стимулираният от инсулин транспорт на глюкоза също е намален в скелетните мускули при пациенти с диабет тип 2. 12 Изненадващо обаче, последните in vitro проучвания показват, че това изглежда се дължи главно на „глюкозна токсичност“. Преинкубацията на тъканни биопсии само за 2 часа при високи нива на глюкоза влошава ефекта на инсулина, 13 докато преинкубацията на мускулите на диабетните мускули за 2 часа при физиологични нива на глюкоза нормализира инсулиновия отговор. Възможно е обаче и времето за преинкубация да надвишава ефекта на други циркулиращи антагонисти върху ефекта на инсулина, като TNFα, интерлевкини и/или свободни мастни киселини (FFA). Наличните понастоящем данни показват, че има само умерени и очевидно функционално критични нарушения при сигнализирането на инсулин преди PKB/Akt в скелетните мускули от пациенти с диабет тип 2. В допълнение, стимулираният от инсулин нарушен транспорт на глюкоза изглежда бързо обратим in vitro чрез предварителна инкубация на тъканни проби в прясна среда, съдържаща физиологична глюкоза. Тези открития също са в съответствие с последователни доказателства, че както съдържанието на протеин в GLUT4, така и експресията на иРНК са нормални в скелетните мускули при диабет тип 2. 7, 16
Съвсем различно е положението при мастната тъкан. Адипоцитите от пациенти с диабет тип 2 също имат значително намаляване на IRS-1-стимулираното фосфорилиране на тирозин. Това обаче се дължи главно на изразяването на 70% намаляване на експресията на IRS-1 протеин. По същия начин общата активност на PI3-киназата се намалява със 70%. За разлика от това, експресията на IRS-2 е нормална и тази молекула също се превръща в основния докинг протеин за стимулирано от инсулин активиране на PI3-киназа. 17 В съответствие с намаленото активиране на PI3-киназа, активирането на PKB/Akt надолу по веригата също е значително намалено, главно поради значително намаляване на стимулираното от инсулин сериново фосфорилиране. Транспортът на глюкоза в отговор на инсулин също е намален в мастните клетки на пациенти с диабет тип 2 поради нарушена инсулинова сигнализация, както и значително намаление (∼ 70–80%) в експресията на GLUT4 протеин и иРНК. 17, 19, 20
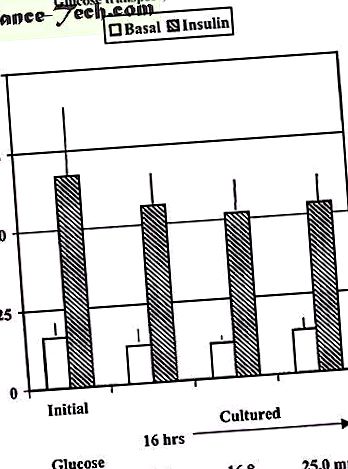
За разлика от мускулните клетки, както бе споменато по-горе, предварителната инкубация на човешките мастни клетки в продължение на 16 часа при физиологични (5,6 mmol/l) или високи концентрации на глюкоза (16, 8 и 25 mmol/l) не пречи на острия стимулиращ ефект на инсулина върху глюкозата (Фигура 1), нито преинкубацията на диабетични клетки при физиологични концентрации на глюкоза възстановява острия инсулинов отговор след 6 часа (непубликувани наблюдения). Това е в съответствие с намалената експресия на GLUT4 протеин в адипоцитите, което вероятно ще изисква по-дълги времена на обръщане.
Поглъщане на глюкоза от експланти на човешка подкожна мастна тъкан преди (първоначално) или след култивиране в продължение на 16 часа при 5, 6, 16, 7 или 25.0 mM глюкоза. След периода на култивиране, изолираните клетки се инкубират с 6,9 nM инсулин и 0,15 uCi [14CU] глюкоза в продължение на 60 минути, за да се определи усвояването на глюкоза. Данните са средно ± sem от четири отделни експеримента.
Изображение в пълен размер
Таблица 1 обобщава основните разлики в нарастващите стимулирани от инсулин събития в мускулите и мазнините от пациенти с диабет тип 2 в сравнение с пациенти без диабет.
Маса в пълен размер
Нормогликемични, устойчиви на инсулин състояния
Експресия на IRS-1 протеин в мастни клетки на затлъстели индивиди или здрави роднини с диабет тип 2 без наднормено тегло. Данни, възпроизведени от Carvalho et al 28 с разрешение.
Изображение в пълен размер
По този начин се наблюдава ниска експресия на гени и протеини на IRS-1 и GLUT4 в мастните клетки на пациенти с диабет тип 2, както и в група здрави индивиди, особено тези със силно наследство за диабет тип 2. В тези групи, надолу по веригата сигналните събития също са засегнати по подобен начин.за инсулин. Здравите индивиди с тези клетъчни аномалии също са значително устойчиви на инсулин in vivo, имат по-високи нива на инсулин и триглицериди на гладно, показващи няколко признака на синдром на инсулинова резистентност (или метаболизъм). Освен това фактът, че тези индивиди са били устойчиви на способността на инсулина да стимулира усвояването на глюкозата in vivo по време на евгликемичната скоба, показва, че мускулната абсорбция е намалена, вероятно поради нарушен транспорт на глюкоза. 34
Малко вероятно е молекулярните аномалии, наблюдавани в мастните клетки, да са вторични спрямо инсулиновата резистентност и хиперинсулинемията. Въпреки че IRS-1 протеинът може да бъде намален чрез дългосрочна и тежка хиперинсулинемия in vitro, 35 много затлъстели индивиди са имали както хиперинсулинемия, така и нормална експресия на IRS-1. Намаленият израз на GLUT4 не може да се обясни с тази възможност.
Както бе споменато по-горе, основната последователна находка в мускулите при диабет тип 2 изглежда е нарушение (бързо обратимо?) При стимулиран от инсулин транспорт на глюкоза и синтез на гликоген, докато активирането на PKB/Akt е нормално. Въпреки че това не изключва големи аномалии в други, все още недефинирани молекулни цели на инсулиновото действие в мускулите, като свързания с c-Cbl протеин (CAP), 36 също е ясно, че има големи разлики между мазнините и мускулите в това отношение. По този начин ниската експресия на IRS-1 в адипоцитите е биомаркер на инсулиновата резистентност и тенденция към диабет тип 2. 28
Тогава ключовият въпрос е защо има тези разлики в инсулиновата сигнализация и експресията на гени и протеини между двете основни инсулинови таргетни тъкани. Въпреки че няма твърди отговори на това, една от възможностите е мастната тъкан да започне и/или да е началната тъкан, в която се развива инсулинова резистентност. Това може да доведе до поредица от събития, при които инсулиновата резистентност се предизвиква или увеличава в мускулите и черния дроб.
Една от възможностите е, че намалената експресия на IRS-1 и GLUT4 в мастните клетки води до намаляване на чувствителността към инсулин в тялото. Както беше споменато по-горе, е малко вероятно намаляване на относително ниския прием на мастна глюкоза (
Наскоро е установено, че мастната тъкан отделя друг пептид, резистин 40, който може да бъде свързан с инсулинова резистентност при затлъстяване. Подобен протеин, наречен FIZZ141, преди това е бил изолиран от възпалителни клетки при белодробна промивка от животни с експериментално индуцирана астма. Цялостната роля на резистина в човешката инсулинова резистентност е предположена. Две скорошни проучвания не са в състояние да открият експресията на резистин в човешките мастни клетки 42, 43 независимо от степента на затлъстяване 42 или инсулиновата резистентност. 43
Друга възможност е, че ниската експресия на IRS-1 и GLUT4 в адипоцитите е свързана с повишени нива на липолиза и циркулираща FFA, което от своя страна нарушава действието на инсулина in vivo. Въпреки това, нивата на FFA на гладно при тези индивиди не се различават от тези на внимателно съчетани индивиди с нормална експресия на тези протеини, но се очаква способността на инсулина да намалява нивата на FFA на ниво.
Въпреки че има много доказателства в подкрепа на ендокринното кръстосано предаване между мазнини и мускули (и черен дроб?), Понастоящем не е ясно как такъв механизъм може да обясни факта, че липоатрофията е свързана и с инсулинова резистентност и диабет. При един животински модел на липоатрофия е установено, че инсулиновата резистентност вероятно се дължи на недостиг на лептин. Прилагането на лептин при тези животни значително подобрява чувствителността към инсулин, вероятно поради повишеното окисление на излишните натрупани липиди в мускулите и други тъкани. За разлика от това, при друг животински модел на обща липоатрофия, лептинът не е в състояние да подобри инсулиновата резистентност, но трансплантацията на мазнини води до значително подобрение. 46
По този начин мастната тъкан произвежда не само пептиди, които могат да индуцират инсулинова резистентност, но и хормони, които могат да повишат инсулиновата резистентност, като лептин 45 и адипонектин. 47, 48, 49 Циркулиращите нива на адипонектин са в положителна корелация с инсулиновата чувствителност и отрицателно свързани с ИТМ. В допълнение, прилагането на адипонектин при животински модели на инсулинова резистентност и диабет подобрява инсулиновата чувствителност. По този начин балансът на производството на хормони на мастната тъкан, който подобрява (като IL-6 и TNFα) или облекчава (като лептин и адипонектин) инсулиновата резистентност, както и други ефекти, вероятно се дължи на няколко фактора, включително мастната маса, хранителен статус и генетичен произход.
Ефекти на тиазолидиндионите върху експресията на IRS-1 и IRS-2
Ефект на пиоглитазон (10 μM) върху експресията на IRS-2 иРНК в мастни клетки от мастен тип, инкубирани в продължение на 16 часа, както е посочено.
Изображение в пълен размер
IRS-2 е основният докинг протеин за активиране на PI3-киназа в адипоцитите, когато IRS-1 е значително намален, както при диабет тип 2, 17, както е описано по-горе. По същия начин IRS-2 функционира като основен докинг протеин в клетките от IRS-1 „нокаутирани“ животни. В допълнение, IRS-2 изглежда е преобладаващата IRS молекула, експресирана в черния дроб и β-клетките 3, 53, а аномалиите в тези органи също изглежда са основна причина за диабет тип 2 при чукане на IRS-2 'животни. Наскоро изследвахме клетъчни нива на IRS-2 при ob/ob животни, лекувани в продължение на 6 дни с TZD, и също така установихме повишена експресия в мастните клетки (непубликувано наблюдение). Понастоящем обаче не е ясно дали TZD също увеличава експресията на IRS-2 в мускулите, черния дроб и β-клетките, но това е предмет на текущо проучване.
Повишената експресия на IRS-2 в мазнините, черния дроб и/или мускулите може да замести намаления IRS-1 протеин и/или нарушеното фосфорилиране и активиране на инсулина, което води до повишена инсулинова чувствителност. В допълнение, прогнозираното увеличаване на експресията на IRS-2 в β-клетки от TZD може да бъде важно както за растежа, така и за функцията. Изглежда обаче привлекателна терапевтична възможност да има агенти, които директно увеличават експресията на IRS-1, тъй като този докинг протеин е основен активатор на PI3-киназата в отговор на инсулин в човешките мастни клетки и за разлика от IRS-2 е устойчив до инсулин значително намален в адипоцитите. Тук предполагаме, че тъканно специфичното намаляване на IRS-1 и GLUT4 експресията на гени и протеини може да играе важна роля за развитието на инсулинова резистентност на цялото тяло, пряко или непряко чрез асоцииране с повишено производство на цитокини и/или други инсулинови антагонистични фактори (Фигура 4). TZD може да отслаби или нормализира този ефект чрез увеличаване на експресията на IRS-2 в адипоцитите и евентуално други целеви тъкани за инсулин и β-клетки на панкреаса.
Потенциална последователност от събития, при които мастната тъкан може да предизвика инсулинова резистентност.
Изображение в пълен размер
Въпреки че този преглед се фокусира върху скорошни открития относно инсулиновата резистентност към ранно увреждане на инсулиновата сигнализация и действие в адипоцитите чрез намалена експресия на IRS-1/GLUT4 и ефекта на TZD върху IRS-1/IRS-2, TZD очевидно предизвиква и други важни промени. в мастната тъкан. Те включват набиране на нови и по-малки адипоцити чрез повишена адипогенеза, процес, при който както IRS-1, така и IRS-2 играят решаваща роля, 56 променяйки генната експресия, пряко или косвено свързана с действието на инсулина, 57 включително инхибиране на цитокини на освобождаването на адипоцити. В допълнение, способността на TNFα да стимулира липолизата и освобождаването на FFA също се антагонизира от TZD. 38
Въпреки това, инсулинът е ключов регулатор на нивата на липолиза и циркулиращите нива на FFA in vivo, а антилиполитичният ефект на инсулина се медиира от активирането на PI3-киназата. По този начин, намалената експресия на IRS-1 и стимулираната от инсулин активност на PI3-киназата също ще свърже инсулиновата резистентност, както се определя от намаленото поглъщане на глюкоза, стимулирано от инсулин, с нарушената способност на инсулина да потиска липолизата.
Благодаря
Изследванията, проведени в лабораторията на автора, са подкрепени с безвъзмездни средства от Шведския съвет за медицински изследвания (проект B-3506), Шведската асоциация по диабет, Европейската общност (QLG1-CT-1999-00674), Gullan и Sven-Erik Karlsson, фонда за памет на Sony Hedenbratt и фондацията IngaBritt и Arne Lundberg.
- Трансформацията на новата съпруга на Kollár преди 6 години той нямаше да се спъне в нея, ето как изглеждаше без мегапиери
- Внимавайте за горещата печка, острите ножове и паданията 13 важни съвета как да предпазите децата от наранявания
- Паническо разстройство и раждане
- Политик; странична атака; и вкл. ziu det; кол; k; Преди; кол; к
- Лютите чушки предпазват от инфаркт - Човек - Наука и технологии