елементи
абстрактно
Безалкохолната мастна чернодробна болест (NAFLD) е едно от най-често срещаните чернодробни заболявания, но нейният основен механизъм е слабо разбран. Тук показахме, че хепатоцитният ядрен фактор 4а (HNF4a), обогатен с черния дроб ядрен хормонален рецептор, е значително инхибиран, докато miR-34a е силно индуциран при пациенти с неалкохолен стеатохепатит, мишки с диабет и мишки, хранени с високо съдържание на мазнини диета. miR-34a е от съществено значение за експресията на HNF4a и регулира натрупването на триглицериди в човешки и миши хепатоцити. miR-34a инхибира секрецията на липопротеини с много ниска плътност и насърчава чернодробната стеатоза и хиполипидемия по HNF4a-зависим начин. В резултат на това повишената експресия на miR-34a или намалената експресия на HNF4a в черния дроб отслабва развитието на атеросклероза при Apoe -/- или Ldlr -/- мишки. Тези данни показват, че пътят miR-34a-HNF4a се активира при нормални условия на метаболитен стрес и може да играе роля в патогенезата на NAFLD и в регулирането на метаболизма на липопротеините в плазмата. Фокусирането върху този път може да представлява нов подход към лечението на NAFLD.
Затлъстяването, диабетът и инсулиновата резистентност са често срещани рискови фактори за безалкохолно мастно чернодробно заболяване (NAFLD) 1, 2, 3, едно от най-честите чернодробни заболявания в световен мащаб. В Съединените щати до 25% от населението има NAFLD от 4, 5. NAFLD се инициира от проста стеатоза, която може да прогресира до неалкохолен стеатохепатит (NASH) след множество "удари", включително възпалителни медиатори, реактивни кислородни видове (ROS) и други подобни, 4, 6, 7. NASH може да прогресира до чернодробна цироза и хепатоцелуларен карцином. Към днешна дата механизмът, лежащ в основата на патогенезата на NAFLD, е слабо разбран. Следователно лечението на NAFLD е ограничено до лечението на свързани синдроми като диабет и затлъстяване 8, 9 .
Хепатоцитният ядрен фактор 4a (HNF4a) е рецептор на ядрен хормон, който играе важна роля както за развитието, така и за физиологията на възрастните. Той е силно експресиран в черния дроб, с по-ниски нива в бъбреците, червата и панкреасните β-клетки 10, 11. HNF4a има силно консервиран ДНК свързващ домен и лиганд свързващ домен. Структурният анализ на HNF4α предполага, че C14 - C18 дълговерижните мастни киселини са здраво свързани с хидрофобната капсула на HNF4α и не могат да бъдат отделени от рецептора при неденатуриращи условия 12, 13. Като такъв, HNF4α е конститутивно активен.
HNF4a контролира базалната експресия на много гени, участващи в метаболизма на жлъчните киселини, липидите, глюкозата и лекарствата. Мутациите при загуба на функция при човешки HNF4α причиняват захарен диабет тип 1 (MODY1) с настъпване на зрялост, характеризиращо се с автозомно доминантно наследяване, ранно начало на диабет и β-клетъчна дисфункция на панкреаса14. Изглежда, че фенотипът на диабета е резултат от намалена глюкозо-стимулирана секреция на инсулин в панкреаса 15. В допълнение към диабетичния фенотип, пациентите с MODY1 също намаляват плазмените триглицериди (TG) и нивата на холестерола 16, 17, 18, вероятно поради нарушена секреция на много ниска липопротеинова плътност (VLDL) в черния дроб 19. В съответствие с намалената секреция на VLDL, ние и други показахме, че загубата на чернодробен HNF4α води до затлъстяване на черния дроб и хиполипидемия при мишки 19, 20 .
МикроРНК (miRNAs) са малки некодиращи РНК молекули, които регулират генната експресия при транскрипционно свързване към 3'-нетранслирания регион (3'UTR) на иРНК. Доказано е, че miRNAs са важни регулатори на клетъчната пролиферация, възпаление и метаболизъм. Последните проучвания показват, че чернодробните miRNAs могат да имат значителен ефект върху метаболизма на липидите и липопротеините 21, 22, 23 .
В този доклад ние изследваме ролята на пътя miR-34a-HNF4α в патогенезата на NAFLD при човека и метаболизма на плазмените липиди и липопротеини. Нашите данни показват, че този път се активира както при пациенти с NASH, така и при пациенти с диабет или мишки с високо съдържание на мазнини (HFD). След това изследваме дали и как този път регулира метаболизма на чернодробните и плазмените липиди и/или липопротеините. И накрая, ние изследваме кои метаболитни стимули стимулират активирането на този път. Нашите данни показват, че пътят miR-34a-HNF4a може да бъде привлекателна цел за лечение на човешки NAFLD.
резултатът
Обратно регулиране на експресията на HNF4a и miR-34a in vivo
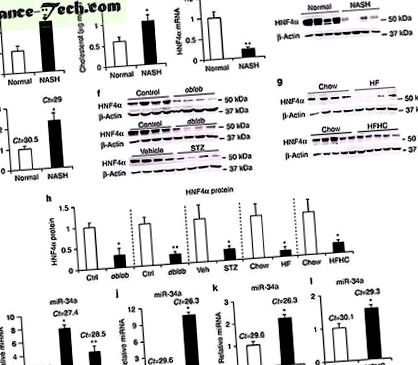
Ние и други по-рано показахме, че загубата на чернодробен HNF4α причинява 19, 20 мазнини при мишки. Тъй като HNF4α е силно запазен сред хората и гризачите, ние изследвахме ролята на HNF4α в развитието на човешки NAFLD. В сравнение с нормалните субекти, пациентите с NASH имат повишен чернодробен TG (фиг. 1а) и нива на холестерол (фиг. 1б). За отбелязване е, че чернодробните нива на HNF4α тРНК са намалени с 80% (фиг. 1в) и нивата на HNF4α протеин са почти неоткриваеми (фиг. 1г и допълнителна фигура 1а) при пациенти с NASH. В съответствие с подчертаното намаляване на чернодробната експресия на HNF4α, броят на целевите гени на HNF4α също е значително намален при пациенти с NASH (допълнителна таблица 1). Доказано е, че MiRNAs играят роля в развитието на NAFLD 24, 25. В черния дроб на пациенти с NASH, miR-34a (фиг. 1д), но не miR-19b или miR-27b (допълнителна фигура 1b), се индуцира> 2 пъти.
За да разберем как miR-34a регулира експресията на HNF4a, изследвахме дали miR-34a се свързва с 3′UTR на HNF4a. Има две силно запазени места за свързване на miR-34a както в човешкия, така и в миши 3'UTR HNF4a (Допълнителна фигура 8а, b). Както е показано на ФИГ. 3i, miR-34a миметикът значително потиска активността на промотора на луциферазата, свързан с Hnf4a3'UTR, и тази репресия е премахната, когато второто свързващо място на miR-34a (mutB) е мутирало. За да потвърдим in vitro данни, ние свръхекспресирахме кодиращата област Hnf4a плюс див тип или мутант 3′UTR при специфични за черния дроб мишки Hnf4a -/-. Свръхекспресията на miR-34a значително намалява екзогенните нива на HNF4a протеин, когато кодиращият регион Hnf4a е свързан с див тип 3′UTR или 3′UTR с мутации в първото място на свързване на miR-34a (mutA) и това намаляване е отменено, когато кодиращата област Hnf4a беше слята с 3 toUTRs с mutB (Фиг. 3j). По този начин нашите in vitro и in vivo данни показват, че miR-34a инхибира експресията на Hnf4a чрез свързване към втория 3′UTR свързващ сайт.
HNF4α регулира атерогенезата и енергийния метаболизъм
Загубата на функционални мутации в HNF4α причинява хиполипидемия при пациенти с MODY. Все още не е известно дали пациентите с MODY1 предпазват от атеросклероза. Тъй като чернодробният HNF4α е значително намален при различни метаболитни стресове (Фиг. 1), ние изследвахме ефекта от острата срещу хроничната загуба на чернодробен HNF4α върху развитието на атеросклероза. Остър нокдаун на чернодробния Hnf4a от shRNA при Apoe -/- мишки в продължение на 3 седмици причинява> 50% намаление на общите плазмени нива на холестерола и 30% намаление на плазмения TG в западната диета (допълнителна фигура 9a-c). Анализът на плазмените липопротеинови профили чрез флаш протеинова течна хроматография (FPLC) показва, че загубата на чернодробен Hnf4a намалява плазмения VLDL холестерол и LDL холестерола (фиг. 4а) и VLDL TG (фиг. 4б). В съответствие с промените в плазмените липиди и липопротеини, остър нокдаун на чернодробния Hnf4α при Apoe -/- мишки намалява размера на аортните лезии с> 50% (фиг. 4в и допълнителна фиг. 9г). В допълнение, загубата на чернодробен Hnf4a при Apoe -/- мишки увеличава натрупването на TG в черния дроб (фиг. 4г) и намалява експресията на MTP и ApoB протеин (допълнителна фигура 9д). Тези данни показват, че острата загуба на чернодробен HNF4α намалява развитието на атеросклероза при Apoe -/- .
Чернодробният miR-34a инхибира атерогенезата при Ldlr -/мишки -
Констатацията, че miR-34a регулира липидния метаболизъм чрез инхибиране на HNF4α (фиг. 3), ни накара да поставим под въпрос дали miR-34a също регулира развитието на атеросклероза. Свръхекспресията на miR-34a при Ldlr -/- мишки, хранени със западна диета, намалява общия плазмен холестерол (фиг. 5а) и нивата на TG (фиг. 5б). Данните от FPLC анализ показват, че miR-34a намалява нивата на VLDL и LDL холестерол (фиг. 5в), както и VLDL TG (фиг. 5г). В резултат свръхекспресията на miR-34a в черния дроб намалява размера на атеросклеротичните лезии с> 50% както в аортните корени (фиг. 5д, е), така и в аортата (фиг. 5ж, ч) на Ldlr -/- мишки. В черния дроб свръхекспресията на miR-34a в Ldlr -/- мишки инхибира чернодробната експресия на HNF4a, ApoB100 и ApoB48 (фиг. 5i) и повишените нива на TG в черния дроб (допълнителна фигура 11). По този начин, или свръхекспресията на чернодробна miR-34a (фиг. 5) или инхибиране на чернодробния HNF4α (фиг. 4) може да осигури защита срещу развитието на атеросклероза.
80%. В резултат на това някои от известните Hnf4a целеви гени също са намалени, докато някои други остават непроменени при тези мишки (Допълнителна таблица 2). Други селективни фактори също могат да допринесат за селективната регулация на HNF4a целеви гени при мишки, хранени с HFD.
Choi et al. 38 заявява, че miR-34a също намалява нивата на NAD + и активността на SIRT1, като насочва NAMPT, ограничаващ скоростта ензим за синтез на NAD +. Въпреки че е известно, че SIRT1 играе важна роля в метаболитния контрол, включително чернодробния метаболизъм на TG, остава да се определи дали SIRT1 играе роля в регулирания от miR-34a метаболизъм на TG. Според нашите убедителни данни, miR-34a повишава нивата на TG в черния дроб чрез инхибиране на HNF4a. Интересното е, че свръхекспресията на miR-34a селективно регулира някои целеви гени на HNF4a (фиг. 3), което може да бъде резултат от непълно инхибиране на експресията на HNF4a и независима от HNF4a генна регулация.
Друго важно откритие на това проучване е, че ние демонстрираме, че пътят miR-34a-HNF4a също регулира метаболизма на ApoB плазмосъдържащи липопротеини и развитието на атеросклероза. Известно е, че повишените плазмени нива на съдържащи ApoB липопротеини ускоряват развитието на атеросклероза. Нашите данни показват, че пътят miR-34a-HNF4a насърчава хиполипидемия чрез инхибиране на секрецията на VLDL. В съответствие с това откритие се съобщава, че пациентите с NASH имат намалена секреция на VLDL 39. Поради хиполипидемия или свръхекспресията на miR-34a, или инхибирането/аблация на чернодробната експресия на Hnf4a предотвратява развитието на атеросклероза при мишки Apoe -/- или Ldlr -/-. Тези данни предоставят първите доказателства, които показват, че пътят miR-34a-HNF4a регулира развитието на атеросклероза. Въз основа на нашите проучвания ще бъде интересно да се определи дали пациентите с NASH и/или пациенти с MODY1 са защитени от атеросклероза.
В допълнение към изясняването на ролята на пътя miR-34a-HNF4α в регулирането на метаболизма на липидите и липопротеините, ние също изследвахме как този път се активира при нормален метаболитен стрес. Нашите данни показват, че пътят miR-34a-HNF4a се активира както при p53-зависимите, така и при p53-независимите методи (Фиг. 6j). При пациенти с NASH p53, FFA и холестеролът могат да си сътрудничат за активиране на пътя miR-34a-HNF4a. Въпреки това, p53 не се активира при индуциран от HFD диабет или затлъстяване. По този начин, при последните условия, FFA и холестеролът могат да бъдат основни фактори, които задействат активирането на пътя miR-34a-HNF4a. Една от нашите бъдещи насоки ще бъде да изследваме как FFA и холестеролът активират пътя miR-34a-HNF4α и дали други метаболитни стимули участват в регулирането на този път.
В обобщение, настоящото проучване показа, че метаболитният път, индуцируем от пътя miR-34a-HNF4a, може да играе критична роля в патогенезата на NAFLD и регулирането на метаболизма на липидите и липопротеините в плазмата. Въпреки че загубата на чернодробен HNF4α има благоприятен ефект върху атеросклерозата и енергийната хомеостаза, загубата на чернодробен HNF4α причинява затлъстяване на черния дроб чрез инхибиране на секрецията на VLDL. По този начин, от терапевтична гледна точка, потискането на чернодробната експресия на HNF4α, заедно с подходи, които облекчават чернодробната стеатоза, може да бъде полезно за предотвратяване на развитието на атеросклероза. За разлика от тях, свръхекспресията на чернодробен HNF4α няма съществен ефект върху метаболизма на липидите в плазмата или липопротеините, тъй като HNF4α е един от най-разпространените гени в черния дроб 19. Тъй като експресията на HNF4α е значително намалена при метаболитен стрес (диабет, HFD и NASH хранене), доставката на HNF4α чрез адено-асоцииран вирус или друг носител (и) на генна терапия е жизнеспособен и привлекателен подход за профилактика и лечение на NAFLD, свързан с метаболизма стрес.синдром. Антагонизмът на чернодробната функция от miR-34a antagomir също е осъществим подход, който може да помогне за предотвратяване на развитието на NAFLD. По този начин насочването към пътя miR-34a-HNF4a представлява обещаващ и привлекателен подход за лечение на NAFLD при хора.
методи
Човешки тъкани на черния дроб, мишката и диетата
Мутагенеза, трансфекции и клетъчна култура
аденовируси
Ad-shLacZ, Ad-HNF4a, Ad-shHNF4a, Ad-empty (контрол) и Ad-miR-34a са описани по-рано 19, 35. Когато Ad-HNF4a беше конструиран, само Hnf4a кодиращата област (която не съдържа 3′UTR) беше клонирана в аденовирусния вектор. За разлика от тях, Ad-HNF4a-3'UTR, Ad-HNF4a-3'UTR_mutA и Ad-HNF4a-3'UTR_mutB са създадени чрез клониране на кодиращата област Hnf4a плюс див тип или мутант 3'UTR (с mutA или mutB) в pAd / CMV/V5-Dest вектор (каталог V493-20, Life Technologies), последвано от трансфекция в 293 клетки, за да се получи аденовирус 40. Ad-p53 е закупен от Vector Biolabs (Кат. № 1168). Ad-anti-miR-34a е генериран с помощта на Applied Biological Materials (Британска Колумбия, Канада). Клетките бяха заразени с аденовируси при множество инфекции (MOI) от 5. Мишките бяха инжектирани интравенозно (iv) с 0,5 до 1,5 х 109 pfu аденовируси. Освен ако не е посочено друго, мишките се умъртвяват 7 дни след инфекцията.
PCR в реално време
РНК се изолира, използвайки TRIzol Reagent (Life Technologies, CA). miRNAs бяха изолирани с помощта на mirVana miRNA изолационен комплект (Life Technologies, CA). MRNA нивата се определят чрез количествена верижна реакция на полимеразна обратна транскрипция (qRT-PCR) на 7500 PCR машина в реално време от Applied Biosystems (Foster City, CA), използвайки SYBR Green Supermix (Roche, Indianapolis, IN). Резултатите се изчисляват, като се използват стойности на Ct и се нормализират до 36B4 нива на иРНК. Количествата на MiRNA са количествено използвани TaqMan праймери и сонди (каталог 4427975, Life Technologies, CA) и нормализирани до нива U6.
Тестове за микроРНК на северно петно
Нивата на MicroRNA също се определят чрез Northern blot тестове съгласно инструкциите на производителя (Signosis, Santa Clara, CA. Cat # NB-1001). В анализа на Northern blot, рокли за miR-34a (каталог MP-0602) и U6 (каталог MP-0512) също бяха от Signose.
MTP анализи на активността
Черният дроб се хомогенизира и активността на МТР се измерва в съответствие с инструкциите на производителя (Chylos, Inc, Woodbury, NY. Cat # R100).
Уестърн блот тестове
Изследванията на Western blot бяха проведени с използване на цели чернодробни лизати 41 или основни протеини от чернодробни проби и изображенията бяха събрани с помощта на ImageQuant LAS 4000 (GE Healthcare, Pittsburgh, PA) 42. MTP антитяло (каталог sc-135994), антитяло HNF4a (каталог sc-6556) и антитяло p53 (каталог sc-6243) са закупени от Santa Cruz Biotechnology (Santa Cruz, CA). ApoB антитяло е закупено от Meridian Life Science (K45253G, TN). Р-актиновото антитяло е от Novus Biologicals (каталог NB600-501, CO). Хистоновото антитяло е от Cell Signaling (Beverly, MA). Антителата се използват в концентрация от 1 μg ml-1 .
Антагомир
miR-34a LNA инхибитор/антагомир (LNA-miR-34a; anta-miR-34a; anta-34a) и miRNA скремблиращ се LNA инхибитор/антагомир (LNA-scr; anta-scr) са синтезирани от Exiqon (Дания, Cat # 199900 ). ob/ob мишки или HFD-хранени мишки (хранени с HF диета в продължение на 12 седмици) се инжектират интравенозно или с anta-miR-34a, или с anta-scr веднъж на всеки 6 дни (10 mg kg-1). След три инжекции мишките бяха умъртвени.
Анализ на липиди и липопротеини
Приблизително 100 mg черен дроб се хомогенизира в метанол и липидите се екстрахират в хлороформ/метанол (2: 1 v/v), както е описано. След това нивата на чернодробните триглицериди и холестерола се определят количествено, като се използват реактиви Infinity от Thermo Scientific (Waltham, MA). Плазмените нива на липидите и глюкозата също се определят с помощта на Infinity реагенти. Профилът на липопротеините в плазмата се анализира чрез FPLC, както е описано в 19. Накратко, след инжектиране на 100 μl плазма, липопротеините се пускат с 0,5 ml min-1 в буфер, съдържащ 0,15 M NaCl, 0,01 M Na 2 HPO 4, 0,1 mM EDTA, рН 7,5 и се разделят на Superose 6 10/300 GL. колона (GE Healthcare) чрез използване на BioLogic DuoFlow QuadTec 10 System (Bio-Rad, CA). Петстотин микролитра проба на фракция бяха събрани.
Секреция на VLDL
C57BL/6J мишки се инжектират интравенозно със специфични аденовируси. На 6-ия ден тези мишки са гладували цяла нощ, последвано от интравенозно инжектиране на Tyloxapol (500 mg kg -1). Взима се кръв в определени часови точки и се определят плазмените нива на TG.
От нова липогенеза
Мишките се инжектират ip с тежка вода (2 H 2 O), за да достигнат 3% обогатяване. След 4 часа се събират черен дроб. Белязани и немаркирани палмитат, глицерол (триглицериди) и холестерол се анализират чрез масспектрометрия 19, 44 .
Атеросклеротични лезии
Аортата и аортният корен бяха изолирани и дисектирани. Коренът на аортата се измива с буфериран с фосфат физиологичен разтвор, вгражда се в съединение с оптимална температура на рязане и след това се замразява върху сух лед. Серийни криосекции с дебелина 7 μm от средната част на вентрикула до аортната дъга бяха събрани върху предметни стъкла плюс микроскоп (Каталог 12-550-15, Fisher Scientific). В региона, започващ от аортните клапани, се събира всеки друг участък. Секционираният аортен корен или аортата с лице се оцветява с маслено червено О и размерът на атеросклеротичната лезия се определя с помощта на Image-Pro Premier 9.0 (Media Cybernetics, Rockville, MD) 45 .
Разход на енергия
Мишките, хранени със западна диета, бяха поставени в цялостната лабораторна система за наблюдение на животните (CLAMS). Консумацията на кислород, производството на CO 2 и производството на топлина бяха определени 46. Накратко, мишките бяха поставени в клетките за аклиматизация за 40–48 часа. След периода на аклимация, мишките се претеглят и се поставят обратно в клетката за аклимация с предварително претеглена храна. Обменът на газ се измерва при мишки на всеки 30 s. Въздухът в помещението се изпомпва в клетките за калориметрия на мишки при 0,472–0,600 литра в минута (LPM) и въздухът в клетката се взема от 0,4 LPM. Физическата активност се измерва едновременно с помощта на 16 инфрачервени сензора, разпределени на 19 cm. Данните от обяд на ден 1 до обяд на ден 2 (EST) бяха избрани за анализ.
Статистически анализ
Статистическата значимост беше анализирана с помощта на несдвоен двустранен t-тест на Student или ANOVA (GraphPad Prisim, Калифорния). Всички стойности са изразени като средно ± sem. Разликите се считат за статистически значими при P