- елементи
- абстрактно
- Въведение
- Пациенти и методи
- пациенти
- План за трансплантация
- Оценка на ефективността
- Оценка на токсичността, свързана с трансплантацията
- биостатистика
- резултатът
- Характеристики на пациента
- Крайни точки за ефективност
- Токсичност за палифермини
- Токсичност, свързана с трансплантацията
- OS и EFS
- дискусия
елементи
- Трансплантация на костен мозък
- химиотерапия
- Стомашно-чревни заболявания
- Хематопоетични стволови клетки
абстрактно
Palifermin, рекомбинантен човешки кератиноцитен растежен фактор, обикновено се прилага за предотвратяване на мукозит след автоложна трансплантация. Данните за безопасност и ефикасност са ограничени при алогенни трансплантации на хемопоетични стволови клетки (ало-HSCT). Направихме ретроспективно проучване на 251 пациенти, подложени на ало-HSCT, от които 154 получиха перипланта палифермин. При всички пациенти палифермин значително намалява средния брой дни от общото парентерално хранене (TPN, 13 срещу 16 дни, P = 0,006) и контролираната от пациента аналгезия (PCA, 6 срещу 10 дни, P = 0,023), както и продължителност на първоначалния престой в болница (LOS, 32 срещу 37 дни, P = 0,014). Ефектът на палифермин обаче е значителен само при пациенти, получаващи химиотерапевтичен режим, основан на TBI, но не и на BU. При получатели на TBI, палифермин намалява средния брой TPN дни (13 срещу 17 дни, P 1 Въпреки че тежестта може да варира в зависимост от режимите на кондициониране, свързаният с ало-HSCT мукозит може да доведе до значителна заболеваемост, включително болка в устата, изискваща наркотици за аналгезия, анорексия изискващи пълноценно парентерално хранене (TPN), продължителен престой в болница и евентуално животозастрашаващи инфекции, причинени от транслоцирани лигавични бактерии. 2, 3, 4
Кератиноцитният растежен фактор е 28 kDa ендогенен протеин в серия от фибробластни растежни фактори, който функционира като растежен фактор за епителните клетки. Кератиноцитният растежен фактор играе важна роля в заздравяването на епитела след нараняване. 6 Palifermin (Kepivance, шведски сирачен биовитриум) е рекомбинантен човешки растежен фактор на кератиноцити, който е по-стабилен от ендогенния растежен фактор на кератиноцитите поради отстраняването на 23 аминокиселини от неговия N-край (информация за продукта). Предклиничните данни при модели на мишки показват, че приложението на палифермин предпазва от химиотерапия и индуциран от радиация мукозит. 7, 8, 9, 10 Клинично е показано, че Palifermin облекчава мукозита след химиотерапия и автологичен HSCT, базиран на TBI. 11, 12 Въз основа на проучване фаза III при пациенти с автоложна трансплантация, които демонстрират намалена честота и продължителност на мукозит III-IV степен на Световната здравна организация след кондициониране на TBI, Fif одобри палифермин за профилактика на мукозит по време на автоложно и алогенно лечение. HSCT. Въпреки това, има ограничен публикуван опит с палифермин по отношение на ало-HSCT. 13, 14, 15
За да помогнем да определим дали палиферминът е безопасен и ефективен след ало-HSCT, извършихме ретроспективен анализ на нашия опит с палифермин, прилаган при възрастни пациенти, подложени на алоело HSlat с изчерпване на миелоаблативни Т-клетки (TCD) за хематологични злокачествени заболявания. Настройката на TCD е избрана за изследване на ефектите на палифермин при липса на MTX, който обикновено се използва за профилактика на GVHD. Въпреки че TCD не се използва често в Съединените щати, последните положителни данни от няколко центъра подкрепят по-широкото им използване. 16, 17 Това проучване представлява най-големият публикуван опит до момента с подробности за употребата на палифермин по време на ало-HSCT.
Пациенти и методи
пациенти
Изображение в пълен размер
План за трансплантация
Т-клетките бяха отстранени от присадките на BM чрез последователна аглутинация на соев лектин и изчерпване на еритроцитите на овце (девет пациенти). 19 Изчерпване на Т-клетките на PBS-мобилизирани G-CSF се извършва чрез положителна селекция на CD34 + стволови клетки с помощта на магнитен сепаратор ISOLEX 300i, последвано от изчерпване на овчи RBC-розетка (231 пациенти), 20 или положителна селекция на CD34 + стволови клетки като се използва система Miltenyi CliniMACS без последващо изчерпване на еритроцитната розетка на овце (11 пациенти). 16 изчерпани костни мозъци Т-клетки или PBSC бяха инфузирани в рамките на 24-48 часа след завършване на химиотерапията. Режимите на кондициониране включват антитимоцитен глобулин (ATG) за 0-3 дози. Не е осигурена фармакологична профилактика на GVHD, тъй като пациентите са получили напълно ех vivo TCD присадка.
Пациентите, които са получавали палифермин, са получавали лекарството съгласно одобрена схема на дозиране. 12 Три дневни дози (60 mcg/kg/ден) са били дадени преди допускане за трансплантация, като третата доза е дадена най-малко 24 часа преди химиотерапия или лъчетерапия. От 6 часа след инфузията на стволови клетки пациентите получават допълнителни три дневни дози палифермин (60 mcg/kg/ден).
Оценка на ефективността
Бяха събрани данни за броя дни, в които пациентите се нуждаят от TPN и контролирана от пациента аналгезия (PCA) с наркотици. 12, 14 Пациентите са били поставени на PCA от лекуващия лекар след трансплантация, когато пациентите се оплакват от всякаква болка в устата или гърлото, която пречи на преглъщането. PCA е прекратен, когато пациентът не се нуждае от „необходими дози“ при липса на базална доза. Нашият процес на управление на TPN е описан по-горе. Продължителността на първоначалния болничен престой (LOS) след трансплантация от приема също беше определена за всички пациенти.
Оценка на токсичността, свързана с трансплантацията
Диагнозата GVHD е поставена на клинична основа и патологично потвърдена, когато е възможно. Острата GVHD (aGVHD) се класифицира съгласно критериите CIBMTR. 22 пациенти могат да бъдат оценени за aGVHD след трансплантация. Хроничната GVHD (cGVHD) може да бъде оценена при пациенти, преживели> 100 дни. Хроничната GVHD е класифицирана като ограничена или обширна според критериите на Съливан. 23-те критерия за консенсус по NIH не са използвани в това проучване, тъй като тяхната ретроспективна природа ограничава наличните данни за класификация на cGVHD.
Първичната недостатъчност на присадката се определя като отсъствие на възстановяване на неутрофили (500500/μl) до ден 28 и BM биопсия с -5% клетъчност. Вторичната повреда на присадката се определя като загуба на ANC на 18
биостатистика
Сравнихме непрекъснатите резултати от използването на PCA, TPN и LOS между получатели на палифермин и не-рецептори, използвайки t-теста. За да се оцени ефектът на палифермин върху всеки от тези резултати, свързани с мукозит, моделите на линейна регресия бяха коригирани след корекция на възрастта, употреба на ATG и режим на предварително лечение (въз основа на TBI и химиотерапия). Въпреки че не се очаква използването на ATG да повлияе на мукозит, то е преведено в тези многовариантни анализи, за да бъде в съответствие с анализа на времето до развитието на aGVHD. За оценка на ефекта на палифермин върху времето до остра и хронична GVHD са използвани анализ на конкурентния риск и мултивариативно конкурентно управление на контрола на възрастовата регресия, употреба на ATG и предварителна обработка. За оценка на ефекта на палифермин върху резултатите от оцеляването е използван log-rank тест върху OS и EFS. Моделът на регресия на Кокс беше приложен към тези резултати от време до събитие, корекция на възрастта, използване на ATG и режим на подготовка.
резултатът
Характеристики на пациента
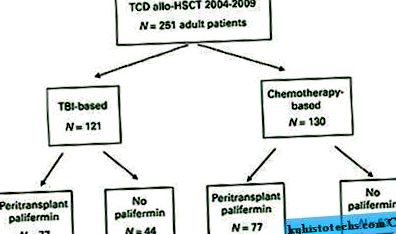
Таблица 1 описва подробно характеристиките на пациента. Средната възраст при трансплантация е 55 години (диапазон 19-73 години). Диагнозите варират и са подробно описани в Таблица 1. Общо 121 пациенти са получили TBI-базирано кондициониране (48%, Фигура 1). От тези пациенти 77 (64%) са получавали палифермин. От 130 пациенти, които са получавали ало-HSCT въз основа на химиотерапия (52%), 77 (59%) са получавали палифермин. Девет пациенти са получили BM като източник на стволови клетки, а останалите пациенти са получили PBSC присадки. Общо 213 пациенти (85%) са получили ATG преди инфузия на стволови клетки и двама пациенти са получили ATG след инфузия на стволови клетки. ATG не е прилаган на други 36 пациенти, всички от които са получавали свързани донори и които са били лекувани с TBI, тиотепа и флударабин (n = 34) или TBI, тиотепа и CY (n = 2). 20.
Маса в пълен размер
Всички с изключение на двама пациенти са постигнали нива на изчерпване на CD3 +
а ) Кумулативна честота на aGVHD при всички възрастни с палифермин. б ) Кумулативна честота на cGVHD при всички възрастни с палифермин.
Изображение в пълен размер
OS и EFS
При медиана на проследяването от 16, 3 месеца (диапазон 0, 03 - 75, 8 месеца) медианата на ОС е 53 месеца (95% CI: 32 месеца - не е постигната), а медианата EFS е 39 месеца (95% CI: 25 месеца - не е достигнато). Не се наблюдава съществен ефект на палифермин върху OS (Фигура 3а) или EFS (Фигура 3b). Възрастта при трансплантация обаче е важен прогностичен фактор за OS (HR 1, 02, 95% CI: 1, 00–1, 04, P = 0,05) и EFS (HR 1, 02, 95% CI: 1, 00– 1, 04, P = 0, 04), който контролира ATG. режим на употреба и подготовка.
а ) OS при използване на palifermin. б ) EFS с използване на палифермин.
Изображение в пълен размер
дискусия
Нашите резултати представляват най-добрият публикуван опит досега с палифермин при получатели на ало-HSCT. Поради ограниченията на ретроспективното проучване, включително възможното пристрастие на лекаря, ние можем да докажем за първи път, че палиферминът не увеличава свързаната с трансплантацията токсичност в алогенна трансплантационна среда и е ефективен след ало-HSCT, базиран на TBI. Предишни проучвания за оценка на палифермин с ало-HSCT бяха ограничени, тъй като бяха с по-малки размери, насочени към предотвратяване на GVHD и/или не използваха палифермин в одобрения понастоящем режим на дозиране. 13, 14, 15
В нашето проучване 154 пациенти, претърпели ало-HSCT, са получили периаран трансплантиран палифермин. Тъй като това беше ретроспективно проучване, не успяхме да докладваме точно ефекта на палифермина върху степента на мукозит на Световната здравна организация. Освен проспективните проучвания, специално предназначени за оценка на мукозит, оценката за мукозит, записана в медицинската карта, е непоследователна. Използвани са клиничните крайни точки, свързани с мукозит, описани в предишни проучвания 12, 14, 15 и ние демонстрирахме значително намаляване на употребата на TPN, употребата на PCA и продължителността на престоя. В отделен анализ на базирани на TBI ало-HSCT реципиенти и химиотерапия, ползата от палифермин е ограничена до реципиенти на TBI. При тази група пациенти палифермин намалява средния брой дни, в които пациентите получават PCA и TPN с 5 дни (P = 0,033) и TPN с 4 дни (P 12
Нашето проучване също така показа, че палифермин не повишава токсичността, свързана с трансплантацията, по време на ало-HSCT. Не се наблюдава видимо увеличение на честотата на aGVHD и cGVHD или неуспех на присадката при тази голяма популация пациенти, получаващи одобрена от FDA доза палифермин. Тъй като обаче всички пациенти са получавали TCD алографти ex vivo и ATG, възможно е палиферминът да повлияе развитието на GVHD при други състояния. Освен това няма разлика в OS или EFS между двете групи (P = 0,74 и P = 0,463).
Има ограничени данни за употребата на палифермин по време на алогенна трансплантация. 13, 14, 15 Blazar et al. 13 публикува рандомизирано, плацебо контролирано проучване фаза I/II, оценяващо ефекта на палифермин върху профилактиката на aGVHD, въз основа на предклинични проучвания, предполагащи, че палифермин може да предотврати aGVHD. 24, 25 Шестдесет и девет пациенти са получавали палифермин, докато 31 пациенти са получавали плацебо. Няма разлика между двете групи в честотата на aGVHD, времето за присаждане, рецидив или оцеляване, в съответствие с нашите данни. Анализът на подгрупите разкрива значително намалена честота и умерена тежест на мукозит при пациенти с CY и TBI, но не и BU и CY. Това проучване включва четири различни режима на дозиране, като осем пациенти получават по-малко, а 51 пациенти получават повече палифермин от настоящата одобрена доза. Десет пациенти в проучването са получавали палифермин при едновременно одобрено от FDA дозиране.
Langner et al. 14 също показва ограничена серия палифермин в настройката за ало-HSCT. Те лекуват 30 пациенти с палифермин, които са претърпели ало-HSCT за левкемия и ги сравняват със съответната контролна група в миналото. При пациентите, получаващи палифермин, честотата на мукозит II-IV степен е намалена в сравнение с контрола (60% срещу 80%, Р = 0,04). Пациентите, получаващи палифермин (6 срещу 12 дни, P = 0,003), също са имали намаляване на средната продължителност на мукозит, намаляване на средната обща приложена доза опиоид (150 mg срещу 378 mg, P = 0,04) и употребата на TPN. (15 срещу 26 дни, P = 0,002). В това малко проучване не се наблюдава ефект на палифермин върху хематологичното възстановяване, развитието на aGVHD или OS. По същия начин, Nasilowska-Adamska et al. 15 лекуваха 53 пациенти, трансплантирани за хематологични злокачествени заболявания с палифермин и ги сравниха със съответната историческа контролна група. Ползата за профилактика на мукозит е потвърдена и няма разлика между групите в развитието на какъвто и да е aGVHD. Допълнителни алогенни анализи, специфични за трансплантация, бяха ограничени, тъй като само 24 пациенти, получили палифермин, са подложени на ало-HSCT, докато останалите пациенти са получили автоложна трансплантация.
Накратко, в това голямо ретроспективно проучване ние демонстрираме, че палиферминът е ефективен по време на ало-HSCT и не увеличава токсичността, свързана с трансплантацията в тази среда. Нашето проучване представлява най-голямата кохорта пациенти, лекувани с посочената доза, и следователно има значителен принос за насочване на настоящата клинична практика с това лекарство при ало-HSCT. Тъй като употребата на палифермин в това ретроспективно проучване е объркана с датата на HSCT и други клинични фактори, е необходимо проспективно рандомизирано проучване, за да се потвърдят тези резултати. Понастоящем планираме голямо, многоцентрово проспективно проучване, оценяващо безопасността и ефикасността на палифермин при популация пациенти с миелоаблативен TCD ало-HSCT, базиран на TBI, за да потвърди нашите констатации.