елементи
абстрактно
Наскоро съобщихме, че клофазиминът (CF) има антипироплазмена активност, но не може напълно да елиминира паразитите в гостоприемника. Наличното в момента лекарство против пироплазма, диминазеноацетат (DA), понякога има токсични странични ефекти. В това проучване ние оценихме комбинирана терапия с CF и DA срещу пироплази in vitro и in vivo. В допълнение, нивото на иРНК и количеството на ДНК бяха анализирани в третираната с CF‒ и DA 'Babesia bovis чрез qPCR. Комбинацията CF - DA има адитивен ефект върху Babesia bovis, B. bigemina и B. caballi и синергични ефекти върху Theileria equi. Комбинираната CF-DA химиотерапия срещу B. microti при мишки е по-ефективна от тяхната монотерапия. При лекуваните с CF‒ и DA B. bovis, CF, зависими от дозата, регулирани нива на mRNA и количеството на ДНК екстрануклеарни гени (богати на AT), докато DA регулира надолу не само количеството на ДНК екстрануклеарни гени, но и ядрени гени. гените са леко регулирани надолу или нагоре от CF и DA. И накрая, CF-DA комбинацията има по-висока ефикасност срещу пироплазми, отколкото CF или DA монотерапията. CF и DA могат да имат богата на AT ДНК свързваща активност. Всички резултати предполагат, че комбинираната химиотерапия с CF-DA ще бъде по-добър избор за лечение на пироплазмоза вместо монотерапия с DA.
Бабезиозата по говедата и пироплазмозата по конете причиняват огромни икономически загуби по целия свят, особено в тропическите и субтропичните райони 1, 2. Наличните в момента антипироплазмени лекарства, диминазеноацетат (DA) и имидокарб дипропионат понякога имат токсични странични ефекти 3. Освен това се съобщава за устойчива на DA Babesia gibsoni и развитие на устойчив на имидокарб дипропионат Theileria equi 4, 5. Следователно, спешно са необходими по-малко токсични, евтини и ефективни антипироплазмени химиотерапии.
Наскоро съобщихме, че клофазиминът (CF) има силен инхибиторен ефект върху растежа на пироплазии, но CF не може напълно да елиминира B. microt при мишки 6. CF е антибиотик, използван в комбинирана химиотерапия срещу проказа 7. Съобщава се, че CF едва ли води до развитие на резистентност 8, но Zhang et al. 9 наскоро съобщи, че няколко мутации в гени са свързани с устойчивост на CF при бактерии.
В това проучване ние изследвахме ефекта от комбинацията CF-DA върху in vitro растежа на B. bovis, B. bigemina, B. caballi и T. equi и неговите химиотерапевтични активности срещу B. microti при мишки. В допълнение към анализите за инхибиране на растежа, са изследвани богати на AT ДНК свързващи дейности, за да се определи начинът на действие на CF и DA при B. bovis, като се използва количествен PCR анализ (qPCR).
Резултати и дискусия
Маса в пълен размер
Маса в пълен размер
Маса в пълен размер
Маса в пълен размер
В съответствие с предишното проучване 6, ефектът от 20 mg/kg CF е сравним и понякога по-висок от ефекта от 25 mg/kg DA. Следователно, 25 mg/kg, което е най-високата доза, се счита за изходно ниво за избор на доза при комбинирани терапии в експеримента с мишки. В допълнение, неравномерните съотношения на дозите в комбинации в in vivo теста за инхибиране са подобни на тези в in vitro теста за инхибиране. Растежът на B. microti беше значително инхибиран във всички групи на лечение (II-25 mg/kg DA, III-20 mg/kg CF, IV-15 mg/kg CF и 10 mg/kg DA и V-10 mg/kg) . kg CF и 15 mg/kg DA) в сравнение с нетретираната група (I-0,2 ml сусамово масло и физиологичен разтвор) (Фиг. 1). Статистически значима по-ниска разлика (P 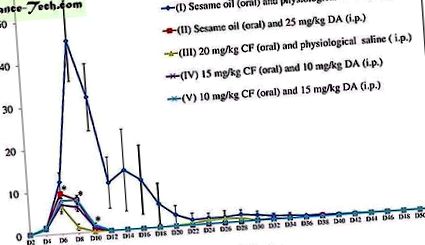
Растеж на B. microti при нетретирани (I), 25 mg/kg DA (II) -, 20 mg/kg CF (III) -, 15 mg/kg CF и 10 mg/kg DA комбинация (IV) - и 10 мишки с доза от mg/kg CF и 15 mg/kg DA комбинация (V) за 52 дни. Стрелката показва 5 последователни дни лечение. Звездичките показват статистически значими (P
Стойности на хематокрит при нетретирани комбинации от 25 mg/kg DA -, 20 mg/kg CF -, 15 mg/kg CF и 10 mg/kg DA - и комбинации от 10 mg/kg CF и 15 mg/kg DA на третирани мишки . Стрелката показва 5 последователни дни лечение. Звездичките показват статистически значими (P
PCR откриване на B. microti от мишки, третирани с CF‒ или DA 'на ден 52 след инфекцията. а ) в проби от кръвна ДНК: G1, нелекувани; G2, 25 mg/kg DA; G3, 20 mg/kg CF; Комбинация от G4, 15 mg/kg CF и 10 mg/kg DA; Комбинация от G5, 10 mg/kg CF и 15 mg/kg DA. ( б - е ) в тъканни ДНК проби: М, размер на маркера 100 bp; Компютър, положителен контрол; Br. Sp., Далак; Li., Черен дроб; Ки., Бъбреци; Той, сърце, NC, отрицателен контрол. Двойните ленти, наблюдавани при някои положителни контроли, представляват ампликоните на първата и втората PCR. Наблюдава се само една лента за намаляване на концентрацията на ДНК на матрицата (данните не са показани). ( ж ) Инфекциозност на B. microti при трансфузирани с RBC мишки. Паразитемията се изчислява чрез преброяване на заразените еритроцити сред 500 еритроцита.
Изображение в пълен размер
CF-DA комбинираните химиотерапии обикновено са по-ефективни от техните монотерапии, въпреки различните режими на дозиране, използвани както в in vitro, така и in vivo инхибиторни анализи, така че комбинираната химиотерапия вероятно ще намали токсичните странични ефекти върху гостоприемника. Необходими са обаче допълнителни проучвания, за да се идентифицират възможните токсични странични ефекти, свързани с комбинираната терапия с CF-DA, за да се потвърди нашата хипотеза.
нивата на иРНК в B. bovis, третирани с CF или DA. ( а ) 4 μM третирани с CF и DMSO паразити. ( б ) паразити, третирани с 15 μM CF и третирани с DMSO. ( ° С ) Паразити, третирани с 6.5 μM DA и Milli-Q вода (M-QW). ( д ) паразити, третирани с 19,5 μM DA и M-QW. Звездичките показват статистически значими (* P 14, 15) Ние предположихме, че сравнението на разликите в гънките в нивата на иРНК на ядрени, митохондриални и апикоопластични гени между CF- или DA-третирани и нелекувани паразити разкрива връзка с ДНК-свързващата активност CF не инхибира РНК полимераза 8 и РНК свързващите дейности на CF и DA са неясни, затова изследвахме количеството на ДНК ядрени, митохондриални и апикопластични гени между CF- или DA и нелекувани паразити, използвайки qPCR анализ.
За анализ на количественото определяне на ДНК промените в количеството на ДНК екстрануклеарните гени при паразити, третирани с 4 и 15 μM CF, зависят от дозата в сравнение с паразитите, третирани с DMSO. гените за котки не са и леко регулирани (фиг. 5а и б). В допълнение, количеството на ДНК на ядрените гени не е регулирано, докато количеството на екстрануклеарните гени е намалено при 6,5 μM третирани с DA паразити в сравнение с паразити, третирани с M-QW (фиг. 5в). В случай на 19,5 μM третирани с DA паразити, се наблюдава регулиране на количествата на ДНК на ядрени гени, докато регулирането надолу се наблюдава на митохондриалните и апикопластните гени в сравнение с неговия контрол (Фиг. 5г).
Количество ДНК в B. bovis, обработено с CF или DA. ( а ) 4 μM третирани с CF и DMSO паразити. ( б ) паразити, третирани с 15 μM CF и третирани с DMSO. ( ° С ) Паразити, третирани с 6.5 μM DA и Milli-Q вода (M-QW). ( д ) паразити, третирани с 19,5 μM DA и M-QW.
Изображение в пълен размер
Резултатите от qPCR предполагат, че CF и DA свързват богати на AT митохондрии и апиколасти, за да инхибират mRNA и ДНК биосинтеза на екстрануклеарни гени в B. bovis. За разлика от това DA не може да инхибира биосинтеза на иРНК на всички гени, както и CF и DA може да не са токсични за иРНК и ДНК биосинтеза на ядрени гени.
И накрая, комбинацията от CF-DA показва адитивен ефект върху in vitro растежа на B. bovis, B. bigemina и B. caballi и синергични ефекти върху ефектите на T. equi и комбинирана химиотерапия с ниски дозови режими на CF и DA имат по-силен инхибиторен ефект върху В микроти при мишки като тяхната монохимиотерапия. Подобен начин на действие на CF и DA, който е свързан с богата на AT активност, предполага, че тези лекарства в комбинация могат да допринесат за сътрудничество срещу паразитите Babesia. Всички тези резултати предполагат, че комбинираната химиотерапия CF-DA е по-добър избор при лечението на пироплазмоза при животни в сравнение с CF и DA монохимиотерапията. По-нататъшна оценка на ефикасността на комбинираната терапия за B. bovis и B. bigemina при говеда и B. caballi и T. equi при коне ще бъде необходима за бъдещото използване на тази терапия срещу пироплазмоза при животни. В допълнение, изследването на комбинираната терапия с CF и atovaquone, азитромицин или клиндамицин, които понастоящем са налични лекарства за човешка бабезиоза, трябва да се предпочита в бъдещи проучвания.
Материали и методи
Декларация за етика
Всички експерименти с животни са извършени в съответствие с разпоредбите за управление и експлоатация на експерименти с животни и всички експерименти с животни и ДНК, одобрени от Комитета по грижа и използване на животните и Комитета по биобезопасност за патогени и Университета по земеделие и ветеринарна медицина Обихиро, съответно. Хокайдо, Япония (номер за присъединяване на експеримента с животни: 28–110/28–111; ДНК-експеримент: 201325-4/201321-4). Всички експерименти в това проучване са извършени в съответствие с Основните насоки за поведението на животните и свързаните с тях дейности в академични изследователски институти под юрисдикцията на Министерството на образованието, културата, спорта, науката и технологиите, Япония.
Паразити и животни
In vitro култури на щам от Тексас от B. bovis, аржентински щам B. bigemina и щамове USDA B. caballi и T. equi се поддържат, както е описано по-горе 25, 26, 27 .
Мюнхенски щам на B. microti и осемседмични женски мишки BALB/c (закупени от CLEA Japan, Inc., Токио, Япония) бяха използвани за експерименталния модел с животни.
Химикали и реактиви
Всички химикали и реагенти са закупени от Sigma-Aldrich (Токио, Япония), с изключение на DA (Novartis Animal Health). CF и DA се разтварят при 10 mM в DMSO и M-QW като основни разтвори за in vitro анализа за инхибиране. CF и DA разтворители (DMSO и M-QW) бяха използвани в контролни култури при същите концентрации, които се използват за приготвяне на най-високата концентрация на тези лекарства във всеки ин витро тест за инхибиране. За in vivo анализа на инхибиране, 10, 15 и 20 mg/kg CF и 10, 15 и 25 mg/kg DA се разтварят в сусамово масло и физиологичен разтвор в автоклав (0.9% NaCl w/v, рН 7.2). непосредствено преди лечението.
Ин витро анализ на инхибиране на CF-DA комбинация
Оценка in vivo на химиотерапевтичната активност на комбинации CF - DA
Анализът на in vivo инхибиране се извършва, както е описано по-горе. Накратко, мишки (5/група) се инжектират интраперитонеално с 1 х 10 7 В-микро-инфектирани еритроцити. Паразитемията и хематокритът се наблюдават на всеки 2 и 4 дни чрез микроскопия и автоматизиран хематологичен анализатор Celltac и MEK-6450 (Nihon Kohden Corporation, Токио, Япония). Когато паразитемия над 1% се наблюдава при всички мишки, групи I, II, III, IV и V се третират с 0,2 ml сусамово масло и физиологичен разтвор като нетретирана контрола, 0,2 ml сусамово масло и 25 m/kg DA, 20 mg ./kg CF и 0,2 ml физиологичен разтвор, 15 mg/kg CF и 10 mg/kg DA и 10 mg/kg CF и 15 mg/kg DA. CF и сусамово масло и DA и физиологичен разтвор се прилагат перорално и интраперитонеално, съответно, в продължение на пет последователни дни. Паразитемията се изчислява чрез преброяване на заразените еритроцити сред 2000 еритроцити, като се използват оцветени с Giemsa тънки кръвни мазки, приготвени на всеки два дни, докато в нито една мишка не е открит паразит. Експериментът се повтори три пъти.
PCR откриване и инфекциозност на третирани B. microti
След in vivo анализа за инхибиране всички мишки бяха анестезирани и след това бяха събрани кръв (събрана чрез сърдечна пункция), мозък, сърце, далак, бъбреци и чернодробни тъкани и използвани за екстракция на ДНК. PCR анализът се провежда, като се използва процедура 6, описана по-горе .
1 × 10 8 еритроцити от групи I - V бяха трансфектирани в 5 нови групи мишки (3/група) чрез интраперитонеално инжектиране. Паразитемията се наблюдава с оцветени с Giemsa тънки кръвни мазки, приготвени на всеки три дни в продължение на 36 дни.
Двудневен тест за инхибиране и ранни морфологични промени и развитие на B. bovis, третирани с CF или DA
Деветдесет микролитра GIT културална среда, съдържаща CF при 0, 1, 0, 5, 1, 1, 5, 2, 2, 5, 3 и 4 μM или DA при 0, 01, 0, 05, 0, 1, 0, 25 .0, 5, 1 и 2 μM, 0.04% DMSO или 0.08% M-QW бяха добавени към 96-гнездова културална плоча в три екземпляра. 10 микролитра 1% паразитирани еритроцити (10% хематокрит) бяха добавени към всяка ямка 27,29. Културите се инкубират в продължение на 2 дни и средата с лекарства и контроли се променя на 0 и 1 ден от културите. Стойностите на IC25, IC50 и IC75 бяха определени на 2-ия ден от културата под микроскоп и флуоресцентен анализ, отделно, както е описано по-горе с малка модификация 27, 29. Експериментът се повтори три пъти.
Морфологични промени на паразити B. bovis, третирани с CF или DA, са наблюдавани на 0, 5, 1, 2, 4, 6, 8, 12, 24, 36 и 48 часа в стените на червените кръвни клетки чрез микроскопия. Сдвоени и едноклетъчни етапи на интраеритроцитния паразит се наблюдават в 400 iRBCs в оцветяване по Giemsa. Културите се извършват по предходния метод с малка модификация: 900 μl хранителна среда GIT, съдържаща CF или DA при крайни концентрации на IC25, IC50 и IC75, 0,02% DMSO или 0,03% M-QW се добавят към 24-гнездовата културална плоча в трикратно. 100 μl 1% паразитирани еритроцити (10% хематокрит) бяха добавени към всяка ямка. Културните среди с лекарства и контроли бяха променени при 0 и 24 часа култивиране.
Еднодневен анализ на инхибиране и количествено определяне на иРНК и ДНК в B. bovis, третирани с CF или DA
IC 50 и IC 75 CF и DA срещу B. bovis се определят, като се използват 8 различни концентрации на всяко лекарство и контрола (0,4% DMSO или 0,2% M-QW) в три екземпляра. Деветдесет микролитра GIT културна среда (без серум) без лекарства и контроли и 10 μl 1% паразитирани еритроцити (10% хематокрит) бяха добавени към 96-гнездова културна плака на ден 0 от култури, както е описано по-горе, с малка модификация 27 . На 1 ден 90 μl GIT хранителна среда е заменена с GIT културна среда с CF (при крайни концентрации: 0, 5, 1, 2, 3, 4, 10, 20 и 40 μM), DA (при крайни концентрации: 0, 1, 1, 2, 4, 6, 8, 10 и 20 μM) или контроли. Стойностите на IC50 и IC75 бяха определени на 2-рия ден от културите чрез микроскопия, използвайки оцветена с Giemsa оцветител RBC. Експериментът се повтори три пъти.
За да се получат РНК и ДНК, културата се извършва съгласно еднодневен тест за инхибиране с 2000 μl култури в 12-гнездна културна плака, съдържаща 1800 μl GIT хранителна среда и 200 μl iRBCs. Хиляда осемстотин микролитра GIT културна среда е заменена с еднакъв обем GIT културна среда, съдържаща CF или DA при IC50 и IC75 или контроли (при крайни концентрации: 0,15% DMSO и 0,195% M-QW) на ден 1 от култури. Заразените еритроцити се събират на 2-ри ден от култури.
РНК и ДНК бяха извлечени от 200 μl iRBCs с реагент TRIzol (Invitrogen, Калифорния, САЩ) или QIAamp DNA Blood Mini комплект (QIAGEN, Токио, Япония) с разграждане на RNase A (Takara Bio Inc., Otsu, Япония) според според инструкциите на производителя. РНК се пречиства с QIAamp RNA Isolation Blood Mini комплект (QIAGEN, Токио, Япония) с рекомбинантна ДНКаза I смилане (Takara Bio Inc., Otsu, Япония) и след това се подлага на синтез на cDNA, като се използва произволен праймер Hexamers (Takara Bio Inc., Япония). Специфични праймери (Таблица S2) са проектирани с помощта на ядра (18S рРНК, тубулинова бета верига и Arm/cat; номера за присъединяване на GenBank: L19077, XM_001611566 и XM_001612062, съответно), митохондрии (cob и cox3; GenBank номер за присъединяване: AB499088) и последователности на апикопласти (tufA и clpC; GenBank: NC_011395) с помощта на софтуера Primer Express® (Life Technologies, Thermo Fisher Scientific). Анализът qPCR се извършва с помощта на Master SYBR® Green PCR Master Mix (Applied Biosystems, Warrington, UK). Многократните промени на целевите гени в сравнение с 18S rRNA се определят при третирани с CF или DA и DMSO или M-QW B. bovis, както е описано по-горе. .
Статистически анализ и формула на ICFIC
Стандартното отклонение беше изчислено в 3 отделни експеримента и статистически значима разлика (Р 1 и 2 и 4 показва значителен антагонизъм, както е описано по-горе 18 .
Оценката на индекса FIC се основава на следната формула:
В qPCR се изчисляват стандартни отклонения в рамките на 3 независимо култивирани култури от нетретирани или третирани групи и всеки цикъл се дублира съгласно описания по-рано метод и принципа на статистическия анализ 30, 31 .
Благодаря
Тази работа беше финансово подкрепена от грант за съвместни изследвания от Националния изследователски център за протозойни болести, Университет по земеделие и ветеринарна медицина Обихиро (28-съвместни-4).
Електронен допълнителен материал
Допълнителна информация
Коментари
Изпращайки коментар, вие се съгласявате да спазвате нашите Общи условия и насоки на общността. Ако смятате, че това е обидно действие, което не отговаря на нашите условия или насоки, моля, сигнализирайте за неподходящо.
- Bhringaraja Естествен растеж на косата Аюрведа Анти косопад Медик
- Pronamel Whitening избелваща паста за зъби 75 мл - Естественият път към здравето
- Denník N се бори с измами Вече летяхме в редакцията, казва редакторът - Понякога Nečas
- Антицелулитни упражнения
- Биофриз за болки в мускулите, ставите и гърба - АПТЕКА ЛЕКАР
