- абстрактно
- Основното
- МАТЕРИАЛИ И МЕТОДИ
- пациенти
- Усилване на мултиплексна лигационна сонда
- Флуоресценция in situ хибридизация
- РЕЗУЛТАТИТЕ
- Пациент А
- Пациент Б
- Пациент С
- Пациент D
- ДИСКУСИЯ
абстрактно
Цел: Вродените малформации са основна причина за новородената заболеваемост и смъртност, а геномният дисбаланс е важна част от тяхната етиология. Целта на това проучване е да се оцени способността на екрана за амплификация на пренатална мултиплексна лигационна сонда за откриване на криптични хромозомни дисбаланси при плодове с ултразвукови аномалии с неизвестна етиология.
Методи: Амплификацията на мултиплексната лигираща сонда беше извършена с три отделни комплекта сонди: две за субтеломерни региони и една за локуси на синдрома на умствена изостаналост. В периода от януари 2007 г. до януари 2009 г. бяха тествани шестдесет и един плода със значителни ултразвукови аномалии и нормален кариотип с резолюция от поне 400 ленти.
Резултати: Идентифицирахме четири небалансирани аранжимента: един del 18pter/усилвател 5pter, един del 9pter, един 15q11q13 микроделетон и един 22q11 микроделетон с нетипично представяне. След генетично консултиране две бременности бяха прекъснати.
Заключение: Амплификационният анализ на сондата за мултиплексно лигиране успя да идентифицира клинично значими промени в 6,5% от плодовете с пренатално идентифицирани сонографски аномалии. Това проспективно проучване подчертава, че скринингът на фетална амплификация с ултразвукови аномалии в пренаталния период е скрининг на мултиплекс амплификация, който е технически осъществим и подходящ за диагностика и прогноза.
Основното
Вродените малформации са основна причина за неонатална заболеваемост и смъртност и се диагностицират при приблизително 3% от населението. Някои вродени малформации се откриват чрез ултразвук в пренаталния период. Стандартният кариотип, получен чрез вземане на проби от хорионни ворсинки или амниоцентеза, разкрива хромозомни аберации при 18–35% от засегнатите плодове. 1, 2 Методи с висока разделителна способност, базирани на флуоресценция in situ хибридизация (FISH), сравнителна геномна хибридизация (разпространение на метафази или CGH масив) и методи за количествена мултиплексна полимеразна верижна реакция (PCR), като мултиплексно усилване, се използват за увеличаване на тази степен на откриване сонда за лигиране. (MLPA) или количествена мултиплексна PCR на къси фрагменти, но тяхното използване при пренатална диагностика остава ограничено.
Специфичният за теломер фелом вече се оказа полезен инструмент за откриване на делеции и дублиране на плодове с големи малформации. 3, 4 Наскоро анализът на CGH фетални проби за откриване на промени в ДНК с малък брой копия беше въведен като осъществим. 5-8 MLPA е бърз, икономически ефективен метод за скрининг за криптични небалансирани субтеломерни пренареждания и интерстициални дисбаланси, открити в региони, свързани с умствена изостаналост (синдром на умствена изостаналост [MRS] -MLPA). MLPA всъщност изисква по-малко от 2 дни и резултатите от MLPA могат да бъдат налични в рамките на 3 дни (в рамките на 4 дни, ако се изисква контрол на FISH). Досега само едно проучване комбинира MRS-MLPA и subtelomeric MLPA, което подобрява степента на откриване на дисбаланс от 5,8% на 10,1% при деца с умствена изостаналост. 9
Това проучване изследва 61 плода с нормални кариотипи и ултразвукови аномалии, предполагащи хромозомни аберации, използвайки субтеломерни MLPA и MRS-MLPA. Доколкото ни е известно, това е първият доклад за субтеломерния MLPA, комбиниран с MRS-MLPA, който се използва като пренатален проспективен скрининг метод при диагностичната оценка на плодовете с ултразвукови аномалии.
МАТЕРИАЛИ И МЕТОДИ
пациенти
Шестдесет и един плода с една или повече малформации, предполагащи хромозомни аномалии и нормален кариотип, бяха включени в нашето проспективно проучване от януари 2007 г. до януари 2009 г. (Таблица 1). Извършен е 400-лентов кариотип за всеки плод с превръзка на RHG и GTG от околоплодна течност или хорионни ворсинки. В случай на сърдечни аномалии е извършен FISH 22q11.2. Когато резултатите от кариотипа и FISH са нормални, ние предлагаме пациентите да продължат с цитогенетични изследвания с помощта на MLPA. Всички 61 пациенти се съгласиха да участват в проучването и беше получено подходящо информирано съгласие. Изследването е проведено в пълно съответствие с Хелзинкските принципи.
Маса в пълен размер
Усилване на мултиплексна лигационна сонда
Сто и двадесет нанограма ДНК бяха използвани в протокола MLPA. Реакциите бяха проведени на TProfessional термоциклер (Biometra, Archamps, Франция). Три микролитра от PCR продукти бяха анализирани чрез капилярна електрофореза на генетичен анализатор ABI Prism 3100 (Applied Biosystems, Courtabeouf, Франция) и количествените данни бяха извлечени с помощта на ABI Prism GeneScan Analysis и Genetyper софтуер (Applied Biosystems). Анализът на данните за MLPA е извършен с помощта на Microsoft Excel. Един пациент с небалансирана транслокация на t (10; 18) (qter; qter) и един пациент с делеция 15q12 бяха включени като положителни контроли във всеки анализ на MLPA P036/P070 и P245, заедно с една отрицателна контрола. Ненормалните резултати са определени като съотношение над 1,3 за печалба и под 0,7 за загуба на генетичен материал.
Флуоресценция in situ хибридизация
Ненормални находки, получени от MLPA, бяха потвърдени от FISH върху метафазни хромозоми съгласно стандартни процедури (Cytocell Technology или Vysis, Inc, Downers Grove, IL), използвайки сонди, разположени в предполагаемите региони плюс контролни сонди. Лимфоцитите от периферна кръв от родители са анализирани от FISH, когато плодът е бил положително тестван за пренареждане.
РЕЗУЛТАТИТЕ
Открихме криптичен дисбаланс при четири от 61-те плода (6.5%), изследвани от MLPA. Идентифицирани са две субтеломерни пренареждания и две перицентромерни микроделеции. Клинични и цитогенетични данни за тези четири случая са представени по-долу.
Пациент А
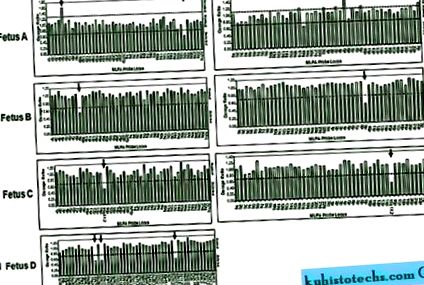
Съотношения на генни дози за субтеломерни MLPA и MRS-MLPA. A, Съотношение на дозата на комплектите SALSA P036 (вляво) и P070 (вдясно) за плод A, показващо 5p усилване на теломерите и 18q делеция на теломери. B, съотношението на дозата на комплектите сонда SALSA P036 (вляво) и P070 (вдясно) за плода B показва 9p делеция на теломера. C, Съотношение на дозата на комплектите сонда SALSA P036 (вляво) и P070 (вдясно) за плода C, показващо заличаването на регион 15q11.2. D, Съотношение на дозата на комплекти сонди SALSA P245 за плода D, показващо заличаването на три сонди, насочени към региона 22q11.21.
Изображение в пълен размер
Пациент Б
26-годишната майка на този плод беше бременна с второто си дете. Първият триместър с ултразвук измерва нухална прозрачност при 1,4 mm и скрининг на серум на майката дава оценка на риска 1: 840 за синдрома на Даун. Семейната анамнеза е незначителна. След 34 седмици от бременността, ултразвуковото изследване разкрива вътрематочно забавяне на растежа и хипоспадия, което води до препоръка за амниоцентеза. Кариотип 46, XY е нормален и FISH анализите за 4p16.3 делеция (Wolf-Hirschhorn, OMIM194190) са отрицателни. Субтеломерен анализ на MLPA разкрива загуба от 9 pter (фиг. 1В). Изтриването е потвърдено от FISH (виж фиг. Б, Допълнително цифрово съдържание 2, //links.lww.com/GIM/A105). Минималният размер, определен от MLPA и FISH, е 810 Kb (DMRT1-, DOCK8-, RP11-143M15-). Анализът на кариотипа и FISH на метафазните разпространения на родителите не показва отклонения. След консултации и в съответствие с френското законодателство родителите решиха да прекъснат бременността за 38 седмици поради високия риск от умствена изостаналост. Клиничната оценка след смъртта потвърждава хипоспадията и разкрива дисморфизъм на лицето с повишено разцепване на овчари, микроретрогнатия, къса шия и широки зърна.
Пациент С
Пациент D
Пациентът е 30-годишен primagravida. Дебелината на нухалната полупрозрачност през първия триместър беше измерена на 1,6 mm, а скринингът на майчиния серум даде оценка на риска от по-нисък синдром 1: 2899. След 25 седмици от бременността, ултразвукът разкри едностранно дисплазирани мултициклични бъбреци и двустранни крака на крака, което води до амценция . Фамилната анамнеза е незначителна и родителските бъбречни ехографски изследвания са нормални. Феталният кетотип, 46, XY, е нормален. След 32 седмици от бременността се откриват значителни полихидрамниони и се извършва MLPA върху криоконсервирани клетки. MRS-MLPA откри микроделеция от 22q11, 2 (фиг. 1D) с минимален размер от 1,68 Mb (CLDN5 -, GP1BB -, SNAP29 -), което беше потвърдено от FISH (виж Фигура D, Допълнително цифрово съдържание 2, // връзки.lww. com/GIM/A105). Родителите отказаха да се подложат на собствено тестване за кариотип и след генетични консултации решиха да продължат бременността. Постнаталната оценка в срок потвърди фетални аномалии и допълнителни малформации бяха диагностицирани. Те включват перимембранозна интервентрикуларна комуникация, ларингеален стридор и тежък гастроезофагеален рефлукс. Теглото е 3540 g, дължината е 50,5 cm, а окципиталната предна обиколка е 36 cm.
ДИСКУСИЯ
Целта на това проучване беше да се оцени техническата осъществимост и полезността на прилагането на MLPA през пренаталния период. Доколкото ни е известно, това е първото проучване за оценка на MRS-MLPA, комбинирано със субтеломерно MLPA при пренатален диагностичен скрининг на плодове с абнормен ултразвук с неизвестна етиология.
Открихме четири субмикроскопски пренареждания, използвайки три различни комплекта сонди MLPA в 61 плода, изпратени в нашата лаборатория за необичайни ултразвукови изследвания. Този дисбаланс беше потвърден от FISH при метафазни разпространения.
Открихме също две интерстициални делеции (3, 3%). Субтеломерните MLPA и MRS-MLPA откриват микроделеция 15q11q13, свързана с полихидрамниоза и хипотония. Bigi et al. 18 публикува първия доклад, описващ възможен фетатип на плода при PWS, който може да бъде идентифициран след 30 седмици от бременността. Те твърдяха, че специфичното положение на ръцете и краката, свързано с намалени движения на плода и полихидрамоний, показва PWS. 18 Обаче плодът С не е показал този тип несъвместимост на крайниците. Dudley и Muscatelli 19 описват генотипно зависима вариация в характеристиките на раждането на PWS, т.е. делеция или еднородна дисомия на майката, което затруднява определянето на фетатип на плода. MRS-MLPA също открива 22q11.2 микроделеция с нетипично представяне. Бъбречната дисплазия често се свързва с микроделецията 22q11.2 и при този синдром са докладвани множество полихидрамниони и кърлежи. 20, 21 Въпреки това, доколкото ни е известно, пренаталната асоциация на едностранни дисплазирани мултициклични бъбреци, двустранни клубни крака и полихидрамниони, идентифицирани при плода D, никога не е била докладвана при синдром на микроделеция 22q11, 2. Заедно тези два случая предполагат, че MRS-MLPA може полезно откриване на микроделеция с нетипично или непълно предродово представяне.