елементи
абстрактно
Промените в чревната микрофлора играят ключова роля във физиологията и метаболизма на гостоприемника; обаче, молекулярните пътища, лежащи в основата на тези промени в диетата, предизвикани от затлъстяването, са неясни. Механистичната цел на сигналния път на рапамицин (mTOR) е свързана с метаболитни нарушения като затлъстяване и диабет тип 2 (T2D). Следователно ние изследвахме дали индуцираните от диетата промени в регулирането на mTOR сигнализиране (диета с високо съдържание на мазнини [HFD] или диета, хранена с диета) и/или терапевтични средства (ресвератрол [специфичен инхибитор на mTOR 1 комплекс)] или рапамицин [инхибитор и на двете mTOR 1 комплекси и 2]) променя състава на чревната микрофлора при мишки. Пероралното приложение на ресвератрол предотвратява непоносимостта към глюкоза и натрупването на мазнини при HFD-хранени мишки, докато рапамицин значително нарушава глюкозния толеранс и чревното възпаление. Изобилието от Lactococcus, Clostridium XI, Oscillibacter и Hydrogenoanaerobacterium се увеличава при условия на HFD; изобилието от тези видове обаче намаля след лечението с ресвератрол. За разлика от това, броят на некласифицираните Marinilabiliaceae и Turicibacter намалява в отговор на HFD или рапамицин. Взети заедно, тези резултати показват, че промените в състава на чревната микробиоза, предизвикани от промени в активността на mTOR, корелират с фенотипите със затлъстяване и диабет.
Затлъстяването е основен рисков фактор за различни хронични заболявания, включително диабет тип 2 (T2D), сърдечно-съдови заболявания, хипертония, безалкохолни мастни чернодробни заболявания и рак 1. Основната причина за затлъстяването е дисбаланс между енергийния прием от храна и енергийните разходи чрез базален метаболизъм, физическа активност и термогенеза 2. Тъй като основният метаболизъм (BMR) представлява приблизително 60-75% от общия енергиен разход 2, ниският BMR на единица телесно тегло е един от рисковите фактори за затлъстяването 3. В допълнение, енергийният баланс се влияе от сложните взаимодействия между генетични, екологични и психосоциални фактори 4. По отношение на енергийния прием, промените в стомашно-чревната (GI) подвижност допринасят за затлъстяването, като регулират не само храносмилателната ефективност, но и апетита и ситостта 5. Интересното е, че последните проучвания показват, че чревната микрофлора играе важна роля в събирането на енергия и затлъстяването чрез взаимодействия с GI подвижност 6, 7 .
Тук изследвахме ефектите на ресвератрол и рапамицин върху mTOR сигнализиране, експресия на метаболитен маркер и състав на чревна микрофлора както при нормални, така и при DIO мишки. Резултатите показват, че ресвератролът и рапамицинът имат значителен ефект не само върху mTOR сигналната активност и експресията на метаболитни маркери, но и върху състава на чревната микрофлора, което предполага, че специфични микробни групи корелират с патофизиологичните фенотипи, свързани със затлъстяването и T2D.
резултатът
Ресвератролът, но не и рапамицин, облекчава индуцираното от HFD затлъстяване
Както се очакваше, телесното тегло (BW) и съхранението на мазнини при мишки, хранени с HFD, бяха по-високи, отколкото при мишки, хранени с нормална диета (NCD) (P 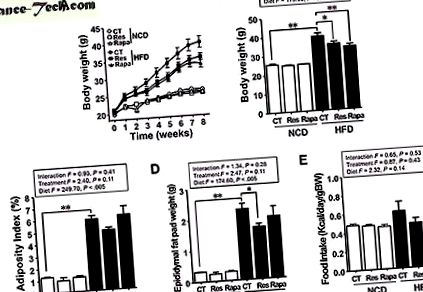
( А, Б ) Нива на кръвната захар (многократно измерва двупосочен ANOVA след тест Bonferroni post hoc, F = 13, 88; P * P ** P # P ## P * P ** P * P ** P 24 и дължина на дебелото черво. Концентрация LCN-2 на изпражненията при мишки с HFD-CT е значително по-висока от концентрацията при мишки с NCD-CT (P
Бактериалните общности бяха групирани с помощта на нетеглен анализ, базиран на разстояние UniFrac (PCoA). ( A ) Основна координата (PC) 1 спрямо PC2 и ( Б. ) PC1 срещу PC3. Процентното отклонение в графичния компютър е отбелязано по осите. ( ° С ) Стълбовидни графики, показващи относителната честота (%) на различни родове бактерии в различни диетични и лечебни групи. Всяка група мишки е представена с различен символ или колона на оста x на графиката и всяко петно или колона показва една проба (n = 5 на група).
Изображение в пълен размер
Значителни разлики в относителното представяне на чревните бактерии в различни диетични и лечебни групи. Ефект ( А, Б ) ресвератрол или ( C, D ) рапамицин за относителен брой от 7 или 10 бактериални рода и йерархичен клъстериращ анализ на тези бактериални профили въз основа на разстояния в Манхатън бяха изследвани при мишки, хранени с NCD и HFD. Данните са изразени като средно ± SEM (n = 5 на група). Стойностите F и p са от двупосочен ANOVA след тест Bonferroni post hoc (допълнителна таблица S2). * P ** P # P ## P
Коефициентите на корелация на Пиърсън включват карти, показващи връзката между метаболитните маркери и редица специфични родове бактерии след ( A ) ресвератрол или ( Б. ) лечение с рапамицин. Поради големия брой проведени корелационни тестове беше използван прагът на значимост P 14. Тъй като метформинът е ключов регулатор на mTOR сигнализирането, това проучване изследва дали механизмите, лежащи в основата на метаболизма на централната енергия на гостоприемника, които се контролират чрез диференциално регулиране на mTOR пътя, включват промени в състава на чревната микрофлора.
В заключение, резултатите, докладвани тук, показват, че промените в състава на чревната микрофлора, дължащи се на лечението с ресвератрол и рапамицин, корелират с промени в BW, съхранение на мазнини, инсулинова резистентност и чревно възпаление при DIO мишки. Въпреки че идентичността на специфични молекули, свързани с HFD, които обогатяват или намаляват определени чревни микробни популации остава идентифицирана, mTOR сигнализирането изглежда е ключов компонент в регулирането на състава на чревната микрофлора при DIO мишки.
методи
Вземане на проби
Пробите на изпражненията са прясно събрани след 8 седмично лечение с ресвератрол или рапамицин и след това се съхраняват при -80 ° С. В края на периода на лечение мишките се анестезират с изофлуран (2-хлоро-2- (дифлуорометокси) -1,1, 1-трифлуоро-етан) след една нощ на гладно (16 часа). Черен дроб, черва, епидидимни мастни накладки и кръвни проби бяха бързо събрани, измити за кратко в PBS и съхранявани при -80 ° C до обработката. Епидидималните мастни подложки бяха претеглени, за да се изчисли AI (g епидидимални мастни подложки/g BW-100). Серумът се събира от кръв с помощта на епруветки Microtrainer® (BD, Franklin Lakes, NJ) за анализ на инсулин.
Анализ на хомеостазата на глюкозата
GTT или ITT са извършени в края на периода на лечение. Мишките, хранени през нощта, са получили натоварване с глюкоза (1,5 g/kg телесно тегло) чрез орален сондаж или инсулиново натоварване (0,75 U/kg телесно тегло) чрез интраперитонеално инжектиране. Измервател на кръвната захар (Accu-Check Performa, Roche) е използван за измерване на нивата на кръвната глюкоза преди и след приложението на глюкоза или инсулин. За изчисляване на QUICKI и K ITT беше използвана актуализирана оценка на хомеостатичния модел (HOMA2), който включва HOMA2-IR (инсулинова резистентност), HOMA2-% B (бета-клетъчна функция на панкреаса) и HOMA2-% S (инсулинова чувствителност), като описаните. по-рано 23, 46, 47. Моделът HOMA2 се изчислява, като се използват глюкоза на гладно и нива на инсулин на гладно, измерени преди умъртвяване и преди въвеждане на глюкоза в GTT.
Имунособентен анализ, свързан с ензимите
За да се оцени активирането както на mTORC1, така и на 2 сигнални комплекса, чернодробни проби бяха изследвани с помощта на комплект за анализ на параметъра cAMP (мишка/плъх) (R&D Systems Inc., Минеаполис, MN) за нивата на cAMP клетки и комплекти за сандвич PathScan ELISA (Cell Signaling Technology, Бевърли, Масачузетс) за общ S6, фосфорилиран S6 (Ser235/236) и общ Akt и фосфорилиран Akt1 (Ser473). За да се изследва фосфорилирането на Akt1, се инжектират 0,5 U инсулин на kg телесно тегло 10 минути преди вземането на кръв. Концентрациите на серумен инсулин бяха измерени с помощта на комплект AKRIN-011T Insulin ELISA (Shibayagi, Gunma, Япония). За да се определи чревно възпаление, нивата на LCN-2 в изпражненията се измерват с помощта на комплект Quantikine ELISA от Lipocalin-2/NGAL (R&D Systems Inc., Minneapolis, MN), както е описано от Chassaing et al. 24. Всички ELISA бяха извършени съгласно протоколите на производителя.
ДНК екстракция, бактериална 16S рРНК генна амплификация и 454 пиросеквенция
Метагеномната ДНК се извлича от фекални проби (0,02 g на проба), като се използва метод на повторно смилане на топчета плюс колона, както е описано по-горе 14. Хиперпроменливите региони V1 и V2 на бактериалния 16S рРНК ген се амплифицират от всяка извлечена ДНК проба, използвайки праймери баркод 14. Пет повторни PCR продукта на проба се обединяват и пречистват с помощта на QIAquick PCR пречистващ комплект (Qiagen, Валенсия, Калифорния). Събраната ДНК се секвенира, използвайки 454 GS FLX титаново пиросеквениране (Roche 454 Life Sciences, Branford, CT). Секвенирането беше извършено с помощта на Macrogen (Сеул, Корея).
Анализ на бактериални 16S рРНК генни последователности и сравнение на общността
Статистически анализ
Данните бяха изразени като средна стойност ± SEM. Всички статистически анализи и коефициенти на корелация на Пиърсън бяха извършени с помощта на софтуера GraphPad Prism (версия 6.0; GraphPad Software, SD, САЩ). Картите на корелационния коефициент на корелация на Пиърсън са визуализирани с помощта на Excel и PowerPoint (версия 2010; Microsoft Corporation, WA, САЩ). В експерименти, сравняващи няколко групи, разликите бяха анализирани чрез двупосочен ANOVA, последван от тест Bonferroni post-hoc. GTT и ITT се анализират, като се използват повтарящи се двупосочни ANOVA с време и група като източници на вариация. Стойности P * P ** P
