елементи
абстрактно
Костта непрекъснато се обновява чрез заместване на старата кост с нова кост чрез костно ремоделиране, процес на трансформация, състоящ се от взаимодействие и баланс между костно-резорбиращите клетки (остеокласти) и костообразуващите клетки (остеобласти) Потенциалният дисбаланс между остеокластите и остеобластите играе решаваща роля в патогенезата на остеопорозата.
Недостигът на естроген при жени в постменопауза стимулира образуването на остеокласти, което води до развитие на постменопаузална остеопороза 2, 3. Счита се, че остеопорозата с дефицит на естроген засяга 40% от жените на възраст над 50 години. Сред наличните в момента анти-остеопоротични лекарства е доказано, че постменопаузалната естроген-заместителна терапия има най-силен защитен ефект срещу остеопороза при жените. За съжаление, употребата на добавки с хормони при жени в менопауза е ограничена поради възможните повишени рискове от рак на гърдата и ендометриума при продължителна употреба 5. Следователно, разбирането на клетъчните и молекулярните механизми, които стимулират промените в клетъчната активност, свързани с ремоделирането на костите, може да идентифицира потенциални терапевтични цели за остеопороза и други свързани с костите патологии.
Остеокластите се получават от недиференцирани клетки в линия моноцити-макрофаги. По-специално, те се стимулират едновременно от два цитокина: стимулиращ фактор на колонията на макрофаги (M-CSF) и активатор на рецептора на лигандния капак на ядрен фактор (RANKL). M-CSF е от съществено значение за оцеляването и разпространението на предшествениците на остеокластите, а RANKL играе ключова роля в диференциацията и активирането на остеокластите 6. Индуцираното от RANKL активиране на RANK върху остеокластни прогениторни клетки води до набиране на фактор 6 (TRAF6), свързан с фактор на туморна некроза (TNF), като по този начин активира няколко сигнални молекули надолу по веригата като NF-κB и митоген-активирана протеин киназа (MAPK). в ранен стадий на диференциация на остеокластите 7. Тази сигнална каскада води до активиране на основните транскрипционни фактори, като активиран Т-клетъчен ядрен фактор c1 (NFATc1) и c-fos, член на транскрипционни фактори 8, 9 на активатор протеин 1 (AP-1) 8, 9, 10 .
Материали и методи
Реактиви и антитела
Минимално необходимата средна алфа (α-MEM) и фетален говежди серум (FBS) са закупени от Life Technologies (Gibco BRL, Grand Island, NY, USA). Рекомбинантна мишка M-CSF е закупена от Miltenyi Biotec (Gladbach, Германия). Рекомбинантна мишка sRANKL е получена от Prospec Biotec (Ness-Ziona, Израел). SB 203580, SP 600125 и PD 98059 са закупени от Enzo Life Sciences (AG, Швейцария). 17β-естроген (Е2) е получен от Sigma-Aldrich (Сейнт Луис, Мисури, САЩ). Антагонистът на естрогенния рецептор (ER) ICI 182, 780 е закупен от Tocris Bioscience (Бристол, Великобритания). Антитела към PRMT1, ASYM24, редовната или фосфо форма на p65, p38, киназа за регулиране на извънклетъчния сигнал (ERK) и c-Jun N-терминална киназа (JNK) са закупени от Cell Signaling Technology (Danvers, MA, USA). актин и катепсин К са закупени от Santa Cruz Biotechnology (Санта Круз, Калифорния, САЩ).
Остеокластична диференциация и TRAP оцветяване
За генериране на остеокласти, клетки от костен мозък на мишки бяха изолирани от бедрените кости на 6-8 седмични мишки (Samtako, Gyunggi-Do, Корея). След лизис на червените кръвни клетки, останалите клетки на костния мозък се инкубират при 37 ° C в продължение на 3 дни в 5% CO 2 в α-MEM, допълнен с 10% FBS и 1% пеницилин/стрептомицин в присъствието на M-CSF (30 ng/ml). Макрофагите, получени от костен мозък (BMDM), са получени чрез отстраняване на плаващи клетки. Прилепналите клетки (BMDM) бяха използвани като предшественици на остеокластите. BMDM се култивират в присъствието на M-CSF (30 ng/ml) и RANKL (100 ng/ml) за още 3 дни. Образуването на остеокласти се определя чрез оцветяване с устойчива на тартарат кисела фосфатаза (TRAP). След 3 дни клетките се фиксират с фиксиращ разтвор в продължение на 30 s и се извършва TRAP оцветяване с помощта на търговски комплект (Sigma, MO, USA) съгласно инструкциите на производителя. Броят на TRAP-положителните многоядрени клетки (MNC, съдържащ повече от три ядра) се отчита с помощта на светлинен микроскоп.
Експерименти с животни
PRMT1 хаплоинсуфициентни (PRMT1 +/-) мишки на фон C57BL/6 бяха любезно предоставени от Dr. Seung-Hoi Koo (Катедра по наука за живота, Корейски университет, Сеул, Корея). Мишки от див тип (WT) (PRMT1 +/+) бяха свързани с хетерозиготни PRMT1 +/- и братя и сестри бяха използвани в експерименти след генотипиране. Всички мишки бяха настанени в специфично състояние без патогени при стайна температура 22 ± 1 ° С с влажност 50%. Женски мишки на 7 седмици WT (n = 6) и PRMT1 +/- (n = 6) мишки бяха OVX чрез отстраняване на двустранни яйчници чрез дорзален подход под обща анестезия с rompun (10 mg/kg) и zoletil (30 mg)./килограма). Беше извършена фиктивна операция в WT групата (n = 6) чрез идентифициране на двустранни яйчници. След 8 седмици всички мишки бяха умъртвени и бедрените им кости бяха отстранени за микрокомпютърна томография (μCT). За анализа на TRAP костите се фиксират в 10% формалин и се декалцифицират чрез потапяне в 10% етилендиаминтетраоцетна киселина (EDTA) за 10 дни. Всички проучвания върху животни са одобрени от Институционалния комитет по грижата и използването на животните (IACUC) на Националния университет в Чонам (номер на одобрение: CNU IACUC-YB-2016-32).
Уестърн петно
Клетъчните пелети бяха лизирани в реагент за екстракция на протеини на бозайници (Thermo, IL, USA), съдържащ коктейл за инхибитор на протеаза (Sigma, MO, USA) и коктейл за инхибитор на фосфатаза I + II (Sigma, MO, USA). Всеки фракционен протеин се екстрахира съгласно инструкциите на производителя. Количествените нива на протеина се определят по метода на Брадфорд. Екстракти от цели клетки (по 30 μg всеки) се разделят чрез електрофореза на полиакриламиден гел натриев додецил сулфат (SDS-PAGE) и се прехвърлят в амплифицирани нитроцелулозни мембрани. След това мембраните се измиват с буфериран с Tris физиологичен разтвор с Tween 20 (TBST), блокират се с 5% обезмаслено мляко за 1 час и се инкубират с първични антитела (при разреждания, препоръчани от доставчика) за една нощ при 4 ° С. Мембраните след това се измиват с TBST и се инкубират с вторични антитела, конюгирани антитела с пероксидаза от хрян в продължение на 2 часа при стайна температура. Лентите бяха визуализирани с помощта на луминесцентен анализатор на изображения (ImageQuant LAS 4000, GE Healthcare, Великобритания) с помощта на реагентите Amersham ECL ™ Western Blotting Detgents (GE Healthcare, UK).
Костна резорбция и тестове за оцветяване на актинов пръстен
За анализа на костната резорбция, BMDM се култивират в продължение на 4 дни с M-CSF (30 ng/ml) в присъствието или отсъствието на RANKL (100 ng/ml) върху повърхностна плоча за анализ на Osteo (Corning Inc., NY). За количествено определяне на резорбционните пропуски, клетките се отстраняват с 20% SDS, последвано от обширно измиване с дестилирана вода и сушене на въздух. Областите, погълнати от дисковете, се наблюдават под микроскоп (Eclipse Ni-U, Nikon, Япония). За да се оцени образуването на актинов пръстен от остеокласт-подобни клетки, зрели BMDM остеокласти се приготвят чрез третиране с M-CSF (30 ng/ml) в присъствието или отсъствието на RANKL (100 ng/ml) в продължение на 3 дни върху покривно стъкло. клетките бяха фиксирани и проникнати с 0,2% Triton X-100/фосфатно буфериран физиологичен разтвор (PBS), последвано от оцветяване с Alexa Fluor 594-фалоидин (Invitrogen). След това клетките се посяват и ядрата се оцветяват с 4 ', 6-диамидино-2-фенилиндол (DAPI) в ProLong Gold Antifade Mounting Medium (Invitrogen, Carlsbad, CA, USA).
трансфекция на siRNA
Малки интерфериращи РНК (siRNAs) за PRMT1 (Santa Cruz) и контролни siRNAs (Qiagen) бяха използвани за заглушаване на ендогенната експресия на PRMT1. Всяка siRNA (50 nM) се трансфектира в BMDM, като се използва Lipofectamine ™ RNAiMAX реагент (Carlsbad, CA, USA) след метода на пряка трансфекция, съгласно инструкциите на производителя.
Верижна реакция в реално време (qPCR)
Обща РНК се екстрахира от клетки, използвайки TRIzol, монофазен разтвор на фенол и гуанидин изотиоцианат, закупен от Invitrogen (Карлсбад, Калифорния, САЩ). След това 1 μg РНК се транскрибира обратно в комплементарна ДНК (cDNA), като се използва системата за обратна транскрипция RT Premix (AccuPower, Сеул, Корея) с праймери oligo-dT18. След това се извърши qPCR, като се използва cDNA като шаблон с Power SYBR Green (Applied Biosystems, Warrington, UK). Използвани са следните праймери: PRMT1, 5'-CCTCACATACCGCAACTCCA-3 'и 5'-CATCCAGCACCACCTTGTCT-3'; c-fos, 5'-CCAGTCAAGAGCATCAGCAA-3 'и 5'-AAGTAGTGCAGCCCGGAGTA-3'; NFATc1, 5'-CTCGAAAGACAGTGGAGCAT-3 'и 5'-CGGCTGCCTTCCGTCTCATAG-3'; ТРАП, 5'-CTGGAGTGCACGATGCCAGCGACA-3 'и 5'-TCCGTGCTCGGCGATGGACCAGA-3'; катепсин К, 5'-GGCCAACTCAAGAAGAAAAC-3 'и 5'-GTGCTTGCTTCCCTTCTGG-3'; DC ПЕЧАТ, 5'-CCAAGGAGTCGTCCATGATT-3 'и 5'-GGCTGCTTTGATCGTTTCTC-3'; и β-актин, 5'-AGGCCCAGAGCAAGAGAG-3 'и 5'-TCAACATGATCTGGGTCATC-3'. QPCR данните бяха нормализирани с помощта на β-актин като ендогенен контрол. PCR в реално време се извършва на PCR система в реално време на Rotor-Gene Q (Qiagen, Hilden, Германия), като се използва двустепенен протокол от 95 ° C за 10 s, последван от 40 цикъла от 60 ° C за 60 s.
Ензимно-свързан имуносорбентен анализ (ELISA)
Концентрацията на ADMA в супернатантата на културата беше измерена с помощта на ултразвуков комплект ELISA (Eagle Biosciences, Nashua, NH, USA) съгласно инструкциите на производителя.
Имунофлуоресценция и конфокална микроскопия
Клетките се промиват два пъти в PBS и се фиксират за 10 минути с 4% параформалдехид в PBS. След три измивания в PBS, фиксираните клетки бяха проникнати с 0,2% Triton X-100 и 1% разтвор на говежди серумен албумин беше използван за блокиране. Клетките се инкубират с PRMT1 антитяло (съотношение на разреждане 1: 100) в продължение на 15 часа при 4 ° С. След три промивания в PBS, клетките се инкубират с вторично антитяло към заешки флуоресцеин изотиоцианат (FITC) (Sigma, МО, САЩ). След това клетките се поставят върху предметни стъкла и ядрата се визуализират с помощта на DAPI. Образното изследване на имунофлуоресценцията беше извършено върху микроскоп за лазерно сканиране Leica TCS SP5 AOBS (Leica Microsystems, Хайделберг, Германия), използвайки Leica 63 × маслена мишена (NA 1, 4), разположена в центъра на Гуанджу в Корея. Възбуждане (496 и 405 nm) и излъчване (500 - 535, 449 - 461 nm) бяха наблюдавани за FITC-конюгираната конструкция и DAPI. За всички експерименти времето на експозиция се запазва еднакво за всички проби.
Анализ на луцифераза
За анализа на луциферазата, суровите 264,7 макрофаги са преходно котрансфектирани с pGL4.32-luc2P/NF-KB-RE (Promega, WI, САЩ) и контрола или PRMT1 с вектор на експресия на β-галактозидаза, за да се нормализира експресията на репортерния ген, използвайки Lipofectamine 3000 ( Invitrogen, Карлсбад, Калифорния, САЩ). 48 часа след трансфекцията, хранителната среда се заменя със среда, съдържаща RANKL, последвана от инкубация за 24 часа. Клетките се лизират с пасивен лизисен буфер. Активността на промотора е измерена с помощта на луциферинов бръмбар и GLOMAX луминометър. Реагентите за измерване на активността на луциферазата са закупени от Promega.
Имунопреципитация
RAW 264.7 клетки се инкубират със или без RANKL (100 ng/ml) в присъствието на M-CSF (30 ng/ml) за 24 часа. Клетките се лизират в неденатуриращ лизисен буфер, съставен от 20 mM Tris (рН 7.4), 150 mM NaCl, 1% NP-40, 1 mM EDTA и 5% глицерол. След това 200 μg протеин бяха инкубирани с PRMT1 антитяло и 40 μl протеин агароза G при неденатуриращи условия в продължение на 24 часа при 4 ° C. Имунопреципитатите бяха измити екстензивно, ресуспендирани в 2x пробен буфер, варени в продължение на 7 минути и имуноблотирани.
μCT анализ
Използвана е система Skyscan 1076 с висока разделителна способност за изобразяване на μCT на дисталните бедрени кости. Суровите изображения бяха реконструирани в серийни изображения с напречно сечение с еднакви прагове за всички проби, използвайки софтуер за реконструкция на изображения версия 3.1. Общо 240 стъпала от трабекуларните кости на проксималната бедрена кост, започващи на 80 стъпала от епифизната плоча, са идентифицирани ръчно като области на интерес. Мормометричните параметри на бедрената кост са определени с помощта на софтуер за анализ на данни (CTAn). Трабекуларната морфометрия се характеризира с измерване на костния обем на обем на тъкан (BV/TV), трабекуларен номер (Tb. N), дебелина на трабекулите (Tb. Th) и костна минерална плътност (BMD).
Статистически анализ
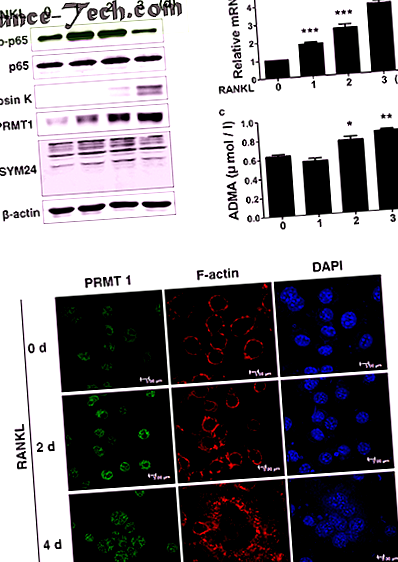
Всички статистически анализи бяха определени с помощта на GraphPad Prism 5 (GraphPad, La Jolla, CA, USA). Статистическите стойности бяха изчислени с помощта на t-критерия на Student за сравняване на средните стойности на двете групи. Еднопосочен дисперсионен анализ (ANOVA) с post-hoc тест на Tukey е използван за сравняване на разликите между множество стойности, за да се оценят разликите между конкретни групи. Резултатът се счита за статистически значим, ако стойността на P е 25, 26. По-специално, нивата на PRMT1 и ADMA протеин се повишават в отговор на лечението с RANKL по време на диференциация на остеокластите (Фиг. 1а). Нивото на експресия на PRMT1 mRNA и концентрацията на ADMA в супернатантата на културата също се повишават в диференцирани RANKL-третирани клетки (Фиг. Lb, c). Както е показано на ФИГ. 1г, лечението на M-CSF и RANKL индуцира добре дефинирано образуване на F-актинов пръстен, което е свързано с прикрепването на остеокласти към костната повърхност и това е придружено от увеличаване на PRMT1 експресията в ядрото.
обява BMDM се култивират с M-CSF (30 ng/ml) и RANKL (100 ng/ml) за посочените периоди от време, за да се предизвика диференциация в зрели остеокласти. Клетъчните протеини бяха извлечени и Western blot с посочените антитела. б Резултати от PCR в реално време, показващи нивото на експресия на PRMT1 иРНК. Резултатите бяха нормализирани до нивото на експресия на β-актин. ° С Експресионно ниво на ADMA в културалната супернатанта, определено чрез ELISA. Резултатите се изразяват като средна стойност ± SD. * стр
RAW 264.7 клетки бяха трансфектирани с контрола или PRMT1 siRNA съгласно метода за пряка трансфекция. След 24 часа клетките бяха трансфектирани с плазмиди pGL4.32 - luc2P/NF-KB-RE и β-галактозидаза. След 24 часа трансфекция, клетките се третират с RANKL (100 ng/ml) в присъствието на M-CSF (30 ng/ml) в продължение на 24 часа и след това се лизират с пасивен лизисен буфер за анализ на луцифераза. Активността на луциферазата беше измерена и нормализирана до активността на β-галактозидазата. Данните са представени като средна стойност ± SD. *** p +/-. Осем седмици след OVX са извършени хистоморфометрични и μCT анализи на трабекуларната кост на дисталната бедрена кост. Сагиталната хистоморфологична парафинова част на бедрената кост беше подложена на TRAP оцветяване. Остеокластичната активност беше значително увеличена в метафизата на WT OVX мишки, но не и при PRMT1 +/- OVX мишки (Фиг. 6а). Морфометричният анализ на микро-КТ показа, че OVX води до значително намаляване на BMD, BV/TV, Tb. N и Tb. Th при WT мишки (Фиг. 6b, c). Такива намаления обаче бяха обърнати при PRMT1 +/- OVX мишки (Фигури 6b, c). Тези резултати показват, че дефицитът на PRMT1 може да предпази мишките от индуцирана от OVX костна загуба.
TRAP оцветяването на дисталните бедрени кости се извършва с помощта на фосфатазни комплекти с левкоцитна киселина и се наблюдава под микроскоп (стрелка). б Показани са представителни двуизмерни изображения на бедрените кости. ° С Обемът на костта на тъканния обем (BV/TV), трабекуларният номер (Tb. N), дебелината на трабекуларната тръба (Tb. Th) и минералната плътност на костите (BMD) бяха определени от измервания на μCT (n = 6). * p +/- OVX мишки потискат активността на остеокластите и загубата на кост и че стимулацията на Е2 е достатъчна, за да блокира диференциацията на остеокластите RANKL 30, ние допълнително проучихме дали експресията на PRMT1 може да бъде повлияна от 17β-естроген (Е2) по време на диференциацията на остеокластите in vitro. BMDMs бяха предварително обработени с Е2 и впоследствие третирани с RANKL и PRMT1 протеин и бяха определени нивата на PRMT1 mRNA. Резултатите показаха, че RANKL-медиираната генна експресия и нивото на експресия на PRMT1 протеин са потиснати от Е2 лечение при BMDM (Фиг. 7а, b). В допълнение, ICI 182, 780, антагонист на ER, премахва инхибиторния ефект на Е2 върху експресията на PRMT1 (Фиг. 7в, d). Тези открития предполагат, че Е2 може да има защитен ефект срещу остеопороза чрез намаляване на експресията на PRMT1.
а, б BMDMs бяха предварително обработени със или без E2 (1 μM) в продължение на 2 часа и след това третирани с RANKL (100 ng/ml) в продължение на 24 часа. Експресията на PRMT1 протеин се изследва чрез Western blot. б Нивото на PRMT1 иРНК беше измерено чрез PCR в реално време и след това нормализирано до ниво на β-актин. ° С, BMDMs бяха предварително обработени с E2 (1 μM) със или без предварителна обработка с ICI 182, 780 (10 μM). След 2 часа клетките се третират с RANKL (100 ng/ml) в продължение на 24 часа. Протеините се екстрахират и се подлагат на Western blot анализ с PRMT1 и β-актин антитела. Данните са представени като средна стойност ± SD. * p +/-) мишки и тези резултати предполагат, че PRMT1 може да допринесе за диференциацията на остеокластите и остеопорозата.
Предишни проучвания са предоставили доказателства, че ADMA, продукт PRMT тип 1, може да участва в развитието на остеопороза. Kanazawa et al. съобщава, че при пациенти с диабет серумните нива на диметиларгинин са свързани с наличието на вертебрални фрактури 31. Lu et al. демонстрира, че повишаването на серумните нива на ADMA е свързано с възрастово намаление на BMD32 при плъхове. В това проучване открихме, че нивата на ADMA се повишават в клетъчната култура по време на RANKL-индуцирана диференциация на остеокластите. Въпреки че няколко проучвания съобщават, че ADMA е свързан с различни метаболитни заболявания 33, 34, са необходими допълнителни проучвания, за да се разкрие точната роля на ADMA като рисков фактор за диференциацията на остеокластите и остеопорозата. Освен това те трябва да изяснят клиничното значение на нивата на ADMA при пациенти с остеопороза.
И накрая, нашите резултати показаха, че експресията на PRMT1 е увеличена в третираното с RDMKL ядро на BMDM чрез JNK-медииран сигнален път (Фиг. 7д). PRMT1 е от съществено значение за индуцирана от RANKL активност на остеокластите, костна резорбция и регулиране на свързаните с остеокластогенезата гени. В допълнение, дефицитът на PRMT1 намалява in vivo остеокластичната активност и загубата на кост при OVX мишки. По този начин PRMT1 може да бъде терапевтична цел за лечение на развитието и прогресията на остеопорозата.
Благодаря
Това проучване беше подкрепено с грант (2017R1D1A1A02019106) от Националната изследователска фондация (NRF), финансиран от корейското правителство.
- Ендометриозата допринася за привлекателността на жените на Unilabs
- Специфичната делеция на traf3 в b лимфоцитите води до развитието на b-лимфом при мишки - левкемия
- Допринася ли здравноосигурителната компания за диета без глутен Ако да, за какво; Икономическа среща
- Изпитвате намалена производителност и умора Вашият живот може да е в опасност
- PELION - Унгария - Tapolca - най-ниска цена от 0 € - HELLAS TRAVEL