абстрактно
Ендоморфин-2 (Tyr-Pro-Phe-Phe-NH2; EM-2) и ендоморфин-1 (Tyr-Pro-Trp-Phe-NH2; EM-1) са изолирани от говеда (Zadina et al, 1997) както и човешки мозъци (Hackler et al., 1997) и се считат за ендогенни лиганди за мю-опиоидния рецептор (Goldberg et al., 1998; Zadina et al., 1997). Имунореактивността на EM-2 и EM-1 присъства на видно място в зони, в които се концентрират мю рецепторите. Големи количества EM-2-подобна имунореактивност (Schreff et al., 1998) и EM-1-подобна имунореактивност (Martin-Schild et al., 1999) са открити в nucleus accumbens (NAc), което съдържа различни подтипове опиати . рецептори (mu-, капа и делта-опиоидни рецептори). Фармакологично тези два ендоморфина са мощни аналгетици и проявяват подобни свойства (Goldberg et al., 1998). Както EM-2, така и EM-1 произвеждат чувствителни на налоксон чувствителни антиноцицепции в теста за движение на опашката (Stone et al, 1997). Проучванията за фармакологична интервенция обаче също показват, че механизмите на действие на двата ендоморфина не са напълно идентични. По този начин антиноцицептивният ефект на ЕМ-2 е по-чувствителен към налоксозазин, отколкото ЕМ-1 (Sakurada et al, 1999, 2000, 2001, 2002). Изследвания на Sakurada et al.Предполагат, че EM-2 действа предимно като агонист на mu1-опиоиден рецептор, а EM-1 като агонист на mu2-опиоиден рецептор.
Активирането на мю-опиоидни рецептори в NAc предизвиква голямо и бързо увеличаване на изтичането на натрупване на допамин. По този начин, фентанил, агонист на mu рецептора, увеличава обратния изтичане на налоксон на α-допамин допамин (Yoshida et al, 1999). Способността на EM-2 и EM-1 да променят извънклетъчното количество натрупан допамин при свободно движещи се плъхове не е проучена. Поради това анализирахме ефектите на EM-2 и EM-1 върху извънклетъчното количество допамин в NAc на свободно движещи се плъхове, използвайки наскоро подобрена техника на микродиализа, която позволява он-лайн мониторинг на допамин с времева разделителна способност от 5 минути. 20 минути (Saigusa et al., 2001; вж. Fusa et al., 2002, 2005; Murai et al., 1994; Saigusa et al., 1997, 1999; Takada et al., 1993; Tomiyama et al., 1993 ., 1995).
ЕКСПЕРИМЕНТАЛНИ ПРОЦЕДУРИ
В началото на експеримента бяха използвани мъжки плъхове Sprague-Dawley (NRC Haruna, Япония) с тегло между 200 и 220 g. Те бяха поставени в контролирана от температурата среда в 12-часов цикъл светлина-тъмнина (период на светлина 0700-1900 ч) със свободен достъп до храна и вода.
хирургия
Плъховете се упояват с натриев пентобарбитон (50 mg/kg, интраперитонеално (ip)). Анестезираните животни се поставят в стереотаксично устройство и направляваща канюла (AP 10,6 mm, ML 1,5 mm, DV 4,0 mm от интрауралната линия; Paxinos и Watson, 1998) се имплантира точно над левия NAc съгласно процедурите, описани по-горе (Fusa и др., 2002, 2005; Saigusa и сътр., 1997, 1999, 2001). За да се избегне камерната система, канюлите, насочени към NAc, са наклонени на 18 ° от средната сагитална равнина. В края на операцията на плъховете беше позволено да се възстановят 7 до 10 дни преди експериментите; направляващите канюли са патентовани с помощта на вложки от неръждаема стомана. Всяко животно е използвано само веднъж. Експериментите са проведени в съответствие с институционалните, национални и международни насоки за грижа и хуманно отношение към животните. Полагат се всички усилия да се сведе до минимум страданието на животните и да се намали броят на използваните животни.
Диализа и неврохимични измервания
наркотици
Използваните лекарства са EM-2 (Peptide Institute Inc., Осака, Япония), EM-1 (Peptide Institute Inc., Osaka, Япония), TTX (Sigma-RBI, St. Louis, MO, USA), CTOP (Sigma -RBI St Louis, MO, USA), налоксон (Sigma-RBI, St Louis, MO, USA) и налоксоназин (naloxonazine dihydrochloride; Sigma-RBI, St Louis, MO, USA). EM-2, EM-1 и CTOP се разтварят в модифициран разтвор на Рингер. EM-2 и EM-1 се вливат през диализната мембрана в продължение на 25 минути, докато CTOP се влива по подобен начин в продължение на 50 минути (започвайки 25 минути преди инфузията на EM-2 и EM-1). Блокаторът на натриевите канали TTX също се разтваря в модифициран разтвор на Рингер за използване при перфузия и се прилага интрацеребрално чрез диализна сонда. Налоксонът се разтваря във физиологичен разтвор. Налоксоназин се суспендира в 2,5% разтвор на Tween-80 и се прилага 24 часа преди началото на инфузията EM-2. Използваните дози се основават на резултатите от горните експерименти (EM-2 и EM-1: Sakurada et al., 2001; TTX: Fusa et al., 2002; Saigusa et al., 2001; Takada et al., 1993; Tomiyama et al. Et al., 1993, 1995, CTOP: Yoshida et al., 1999, налоксон: Yoshida et al., 1999, налоксозазин: Piepponen and Ahtee, 1995). Отчетените дози EM-2 и EM-1 са количеството (nmol) на съединенията за 25 минути перфузионна течност (50 μl), а дозата CTOP е количеството на съединението за 50 минути перфузионна течност (100 μl).
хистология
В края на експеримента плъховете бяха дълбоко анестезирани с натриев пентобарбитон (50 mg/kg, ip) и измити транскардиално с 10% разтвор на формалдехид. Мозъкът беше отстранен, разрязан (50 μm) и оцветен с крезил виолетово, за да позволи поставяне на сондата.
Статистически анализ
Всички стойности са изразени като процент от базовите нива. Сравнението на данните за хода на времето беше извършено с помощта на двупосочен ANOVA (дисперсионен анализ) за повтарящи се мерки с лечение и фактори на времето (повторно). Статистическото значение се счита за P 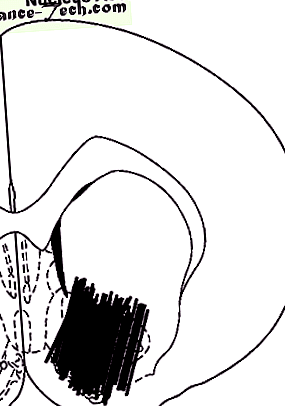
Схематично представяне на местоположението на сондата в NAc. Диаграмата е взета от Атласа на Паксинос и Уотсън; числото представлява предното разстояние (mm) от междузвездната линия.
Изображение в пълен размер
Базално ниво на извънклетъчен допамин в NAc
Първоначалната концентрация на допамин в NAc диализатите е 1,0 ± 0,05 pg/5 минути (средна стойност ± SEM; n = 159).
Ефекти на EM-2 и EM-1 перфузия върху извънклетъчните нива на допамин в NAc
25-минутна инфузия на EM-2 (Фигура 2а; 5 nmol (n = 7), 25 nmol (n = 6) и 50 nmol (n = 6)) или EM-1 (Фигура 2b; 5 nmol (n = 6 )), 25 nmol (n = 6) и 50 nmol (n = 6) до NAc предизвикват дозозависимо повишаване на извънклетъчните нива на допамин в зависимост от дозата: тези ефекти продължават приблизително 10–35 минути (EM-2 - лечение F (2, 96) = 84, 92, P
а) Ефекти от инфузия на носител (n = 6, пълна с диаманти), 5 nmol EM-2 (n = 7, отворени квадратчета), 25 nmol EM-2 (n = 6, запълнени триъгълници) и 50 nmol EM-2 2 (n = 6, отворени кръгове) до NAc при базални извънклетъчни нива на допамин (DA) в NAc. Данните се изразяват като средна промяна за 5-минутни периоди на наблюдение след началото на 25-минутната инфузия EM-2. Вертикалните линии показват SEM. Попълнената лента над оста x показва времето за вливане на превозното средство или EM-2. б) Ефекти от вливане на носител (n = 6, пълни с диаманти), 5 nmol EM-1 (n = 6, отворени квадратчета), 25 nmol EM-1 (n = 6, запълнени триъгълници) и 50 nmol EM-1 1 (n = 6, отворени кръгове) до NAc при базални извънклетъчни нива на допамин (DA) в NAc. Данните се изразяват като средна промяна в 5-минутни периоди на наблюдение след началото на 25-минутна инфузия на EM-1. Вертикалните линии показват SEM. Попълнената лента над оста x показва времето за вливане на превозното средство или EM-1.
Изображение в пълен размер
Невронална зависимост на EM-2 и EM-1-индуцирано преходно увеличение на изтичането на допамин в NAc
TTX (2 μM), инфузиран в продължение на 2 часа чрез диализна сонда, намалява базалните нива на DA с приблизително 70%. Тази инфузия на TTX почти напълно премахва EM-2 (50 nmol; n = 6; Фигура 3a; лечение F (1, 60) = 421, 58: P
(а) Ефекти от перфузията на 2 μM TTX върху 25-минутна инфузия на 50 nmol EM-2 индуцирано увеличение на нивата на DA (допамин) в NAc (n = 6, отворени триъгълници). Данните се изразяват като средна промяна за 5-минутни периоди на наблюдение след началото на 25-минутната инфузия EM-2. Вертикалните линии показват SEM. Отвореният прът над оста x показва периода на TTX перфузия, започнал 120 минути преди началото на инфузията EM-2. Попълненият ред показва времето за инфузия на EM-2. (b) Ефекти от перфузията на 2 μM TTX върху 25-минутна инфузия на 50 nmol EM-1 индуцирано увеличение на нивата на DA (допамин) в NAc (n = 6, отворени триъгълници). Данните се изразяват като средна промяна в 5-минутни периоди на наблюдение след началото на 25-минутна инфузия на EM-1. Вертикалните линии показват SEM. Отвореният прът над оста x показва периода на TTX перфузия, започнал 120 минути преди началото на инфузията EM-1. Попълненият ред показва времето за инфузия на EM-1.
Изображение в пълен размер
Ефекти на антагониста на Mu-опиоидния рецептор върху преходно увеличаване на изтичането на допамин, индуцирано от EM-2- и EM-1 в NAc
Перфузията на NAc с антагониста на мю-опиоидния рецептор CTOP (3 nmol; n = 6) не повлиява интраакумулираната инфузия на увеличаването на извънклетъчното количество на EM-2-индуцирано натрупване на допамин (50 nmol; n = 6). (Фигура 4а; лечение F (1, 57) = 3, 28, P = 0,08; време F (5, 57) = 5, 30, P
Изображение в пълен размер
Ефекти на налоксон върху преходното увеличение на допаминовия поток, индуциран от EM-2- и EM-1 в NAc
Както е показано на Фигура 5а, налоксонът (1 mg/kg, ip, прилаган 20 минути преди интрацеребрална перфузия), който сам по себе си не е повлиял значително базовите нива на натрупания допамин (данните не са показани), не е повлиял EM-2 (50 nmol ) -индуцирано повишаване на нивата на допамин в NAc (n = 6). За да се увеличи очакваната ефикасност на налоксон, налоксон се прилага 10 вместо 20 минути преди приложението на EM-2; Налоксонът отново беше напълно способен да инхибира ефектите на EM-2 (50 nmol) върху нивата на допамин в NAc (Фигура 5b, n = 9). Както бе споменато по-горе, 25 nmol EM-1 произвежда ефекти, повече или по-малко сравними с ефектите от 50 nmol EM-2. Следователно първоначално тествахме способността на налоксон (1 mg/kg, ip, прилаган 10 минути преди интрацеребрална перфузия), който сам по себе си не повлиява значително базовите нива на натрупания допамин (данните не са показани), да антагонизира 25 nmol EM -1 . Това лечение значително намалява индуцираното от EM-1 повишаване на нивата на допамин (25 nmol) в NAc, особено в началния период от 10 до 30 минути (n = 9; Фигура 5в; лечение F (1, 78) = 42, 49, P
Изображение в пълен размер
ДИСКУСИЯ
По-рано показахме, че изходните нива на допамин в NAc зависят до голяма степен от невроналната активност, тъй като повече от 70% от освобождаването на допамин е чувствително към TTX (Saigusa et al, 2001). Следователно се смята, че базалният допамин, измерен в това проучване, се дължи главно на освобождаването на допамин от невроните.
Интраакралната инфузия на EM-2 и EM-1, зависими от дозата, повишава нивата на допамин диализат от плъхове NAc. Количествена разлика се наблюдава между ефектите на EM-2 и EM-1 върху индукцията на увеличаване на изтичането на натрупване на допамин. По този начин способността на EM-2 да повишава натрупаните извънклетъчни нива на допамин е много по-малка от способността на EM-1, когато се тества за широк диапазон от дози (5, 25 и 50 nmol). Максималните ефекти на инфузията на EM-2 и EM-1 с най-висока доза (50 nmol) бяха почти напълно потиснати от интраакумулирана инфузия на TTX (2 μM), което предполага, че при настоящите експериментални условия нарастването на натрупаните нива на допамин, предизвикано от от EM-2- и EM-1 е напълно зависим от невронната активност. Както е обсъдено по-долу, ефектите на EM-1 са медиирани от механизми, които са напълно различни от механизмите, медииращи ефектите на EM-2. Следователно, разликите в ефикасността между EM-1 и EM-2 не могат просто да се отдадат на разлика в афинитета и/или вътрешната активност, а на разликата в механизмите.
Взети заедно, това проучване показва, че интраакумулираната инфузия на EM-2 и EM-1 увеличава изтичането на допамин в NAc чрез механизми, които са напълно различни. Въпреки че ефектите както на EM-2, така и на EM-1 зависят от невронната активност, ефектите на EM-2 не могат да бъдат блокирани от иначе ефективна доза от селективния антагонист на муопиоидния рецептор CTOP или специфичния антагонист на опиоидния рецептор налоксон, за разлика от ефекти на EM-1, които бяха много ефективно потиснати. CTOP, налоксозазин и налоксон. Стигна се до заключението, че ефектите на EM-2 не се медиират чрез опиоидни рецептори, чувствителни към налоксон, за разлика от ефектите на EM-1, които се медиират от mu1-опиоидни рецептори в NAc.
Благодаря
Това проучване беше подкрепено от безвъзмездни средства от Фонда Сато (TS, NK) и Центъра за дентални изследвания (NK), Университетско училище по стоматология в Университет Nihon; Мултидисциплинарен изследователски грант на университета Nihon 2005/2006 (TS, NK, ARC); безвъзмездна помощ за подкрепа на мултидисциплинарен изследователски проект (NK, ARC) и помощ в подкрепа на научните изследвания (# 14 370 609 за NK и # 16 591 897 за TS) от Министерството на образованието, културата, спорта, науката и технологиите, Япония; и Обществото за подкрепа и взаимопомощ за частното училище в Япония (SW, IT, YA, NK).
